酸碱反应
酸碱反应快
最后更新:2022年12月29日|
酸碱反应通常比替换或添加反应快
这是一个非常有机化学中常见的困境当你移动通过后者的部分组织1,然后进入组织2:
当多个反应是可能的,你怎么知道哪一个会发生什么?
之间的钢罩匹配一种酸碱反应和其他类型的反应,哪个赢?
在本帖里,我们假设一个好的经验法则要牢记:酸碱反应快,相对于其他的反应。
这里有三个例子——顺便说一下…这些都是常见的考试技巧的问题!
表的内容
1。酸碱对亲核取代反应(SN2反应)。
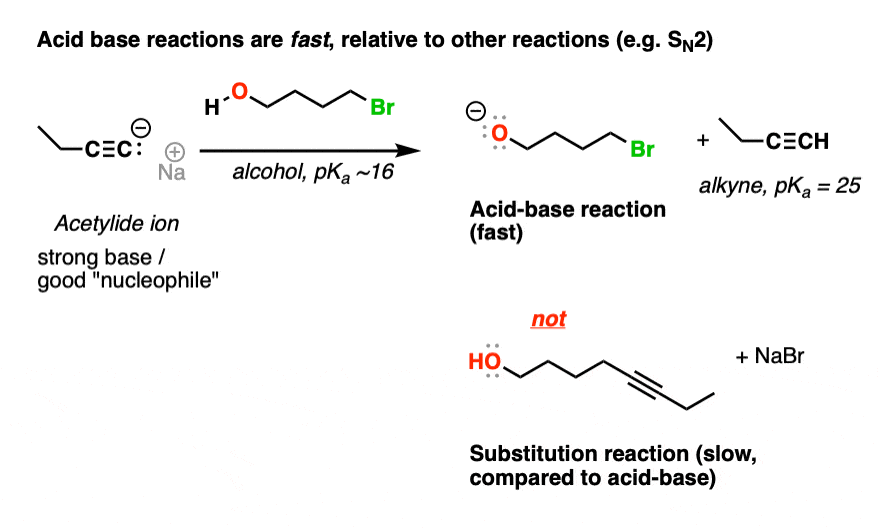
在这里,请注意,我们的亲核试剂(共轭碱一个炔烃,pK一个25)可以删除的质子酒精(pK一个~ 15)或执行一个年代N2在主节点上的反应烷基卤化物。
的区别10pK一个单位之间的炔烃和酒精,deprotonated之间的酸碱反应炔烃(“乙炔化物”,更强的基地)deprotonated酒精(“醇盐”,基地)非常弱有利的。
由于酸碱反应快,相对于其他反应,首选的第一反应是去质子化酒精给共轭碱(“醇盐”)
奖金的问题:是什么最后这个反应的产物,后去质子化?回答下面(注2]
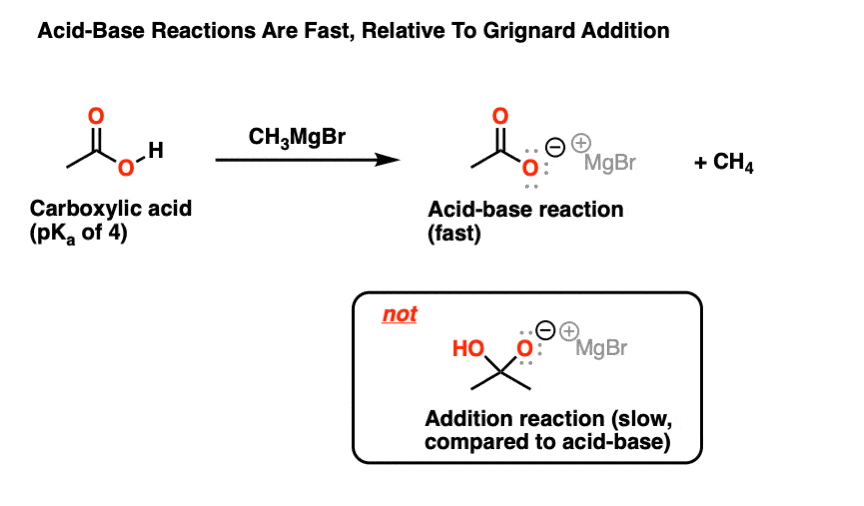
2。酸碱反应和羧酸
格利雅试剂是非常好的亲核试剂反应羰基酮等化合物、醛和酯类。但随着烷烃(pK的共轭基地一个~ 50)他们也非常强大的基地。
当加上一个羧酸(pK一个~ 4或5)结果不一个客人羰基,而是一个酸碱反应(45 pK一个单位是一个非常有利的反应)。
记住,总是很有帮助羧酸是…酸!
3所示。格氏反应分子的羟基官能团
同样适用于反应的格氏试剂和分子羟基除醛或酮。如果只是一个等价的添加,第一件事将会发生去质子化的酒精比的酮羰基碳。
这是只有在添加第二个等效的格利雅除了到酮将会发生。
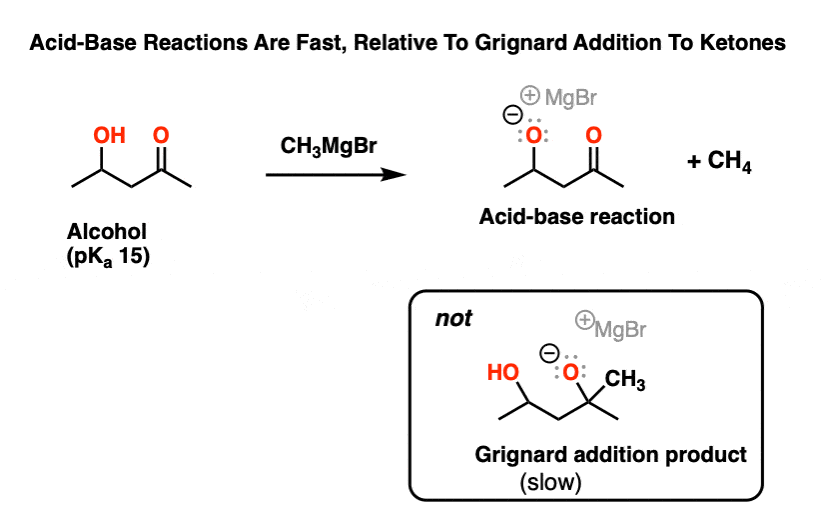
什么年代?
4所示。为什么酸碱反应快:的原则至少运动吗
这里的情况是一个方便的原则在化学中的应用称为至少运动原理。
简单的说,就是这个。
酸碱反应在“杂原子”(这意味着除了碳原子,如O, N, S)通常需要非常小重组原子核的结构后失去一个质子。
因此这些反应快,相对于原子核反应需要移动或重组。
从一个地想删除一个质子。
损失后的氢,氧增加一个新的孤对。但它的杂交不会改变——它开始sp3,还是sp3。所以原子核(当然,除了H)不显著改变在这些反应。没有额外的原子运动换句话说。
然而当债券形成或破碎的碳——例如在SN2反应或增加羰基碳-大量的原子重新安排家具。
例如,SN2通过一个背后攻击,这意味着从分子的几何变化四面体来三方晶系的双锥体(这是5-coordinate过渡状态)然后回到四面体。
在除了反应羰基化合物,我们改变了杂交从sp的碳2对sp3。需要从三角形平面转向四面体几何。
额外的原子运动意味着它将会是一个慢反应,相对于酸碱反应。
底线:酸碱反应氧、硫、氮是快。只要酸碱平衡是合理的(如何使用pKa表吗,一个方便的经验法则对酸碱反应做第一个吃螃蟹的人。
笔记
注1。有趣的是,格氏试剂(烷烃的共轭基地,pK一个~ 50)通常不会deprotonateα碳醛(pK一个~ 18)或酮(pK一个~ 20)。
另一个应用程序的这一原则。删除从一个质子醛或酮需要一个碳氢键断裂,由此产生的基础(称为一个“烯醇化物”)将进行改变杂交从sp3对sp2。因此,它是缓慢的。
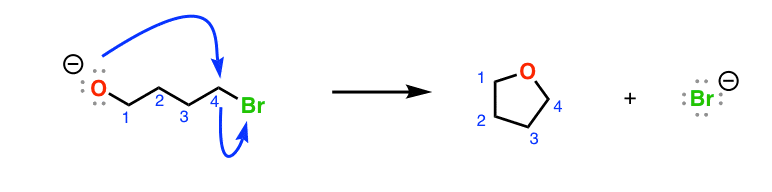
注2。在第一次酸碱反应,deprotonated酒精可以做一个年代N2在主节点上的反应烷基溴化。
(高级)引用和进一步阅读
- 至少核运动的原则。
海恩,J。
物理有机化学的进步、学术出版社,体积15日1977年,1 - 61页。ISSN 0065 - 3160。
DOI:10.1016 / s0065 - 3160 (08) 60117 - 3
海恩教授在这本书一章,俄亥俄州立大学的评论至少ncuelar运动的原则。特别值得注意的是40页的图,这表明HCN最低障碍去质子化的碳基酸,与内部几何的一个小变化一致。
我有一个问题已经困扰我一段时间现在大多因为我有机化学教授并不能解释概念fully-when氢化的最佳时间是烷基或转移反应机理问题可以做吗?我知道卤化烷基/变化可用于一个问题,你有酒精和它与某种类型的卤代烷反应像哈佛商业评论,但还有其他时间可以使用转移?
任何时候你形成碳正离子,当心重组。
忘了补充说,是的,我意识到变化可用于SN1 / SN2反应…也许是最好的如果我留意任何潜在的碳正离子重排可能使碳中心更稳定。
非常感谢总结!
我一直不能理解为什么某些行为是优先于他人。这是一个重要的点,你澄清这么好!
谢谢你!
非常感谢您在网站上所有你的工作。我得到orgo 1汇总表,发现它非常有用。
只是一个问题。为什么破碎的碳氢键导致rehybridazation om醛和酮吗?
难道不是去质子化后仍sp3的孤对吗?
没有
再次感谢你。
你好,如果你deprotonate碳氢键邻酮,长期不会sp3杂化碳。是积极有利的碳re-hybridize sp2,这种设计将孤对p轨道,可以结合p轨道的C = O组。
这种原子运动使去质子化的碳氢键“慢”。
詹姆斯。感谢您的回复!
我购买了总结,意识到我还没准备好总结,和经历的帖子,真的很有帮助。我觉得这将会很好如果你能把这些文章内容为可打印的pdf。我肯定会支付合理的价格这内容易于阅读,携带,和做笔记. . !
为什么在醇醛缩合哦——作为一个较弱的基础比格氏试剂能够deprotonateαH和格氏试剂不是吗
格氏试剂添加羰基-不可逆转。氢氧化可以添加羰基形成半缩醛,但它是可逆的,并最终发生去质子化烯醇化物。
格利雅,去质子化α位置只会发生在当有很多空间体积的羰基碳。碳氢键必须面向90°为了去质子化发生,否则由此产生的负碳离子不会与羰基共振π键