消除反应
热有利于消除反应
最后更新:2022年12月2日|
热有利于消除反应
- 消除反应常与取代反应相竞争
- 一般来说,热倾向于增加的比例消除产品相对于替换产品
- 原因是消去导致溶液中物种数量增加,熵增加(ΔS),温度T的升高使
吉布斯自由能方程中的-TΔS项更大。
目录
- 在其他条件相同的情况下,消去反应比加热的取代反应更有利
- 加热导致消除比取代逐渐增加
- 消除反应导致溶液中物种数量的增加;取代反应则不然
- 溶液中物种数量的增加意味着更大的熵,这意味着吉布斯方程中的-TΔS项随着温度(T)的增加而增加
- 笔记
- (高级)参考资料和进一步阅读
1.在其他条件相同的情况下,消去反应比加热的取代反应更有利
在后面的几篇文章中我们看到了消除反应常与取代反应相竞争。
我们怎么知道什么时候一个反应途径比另一个更受欢迎呢?正如我们将看到的,要完全回答这个问题有几个组成部分,但今天我们将讨论一个简单的经验法则。
假设有一个这样的反应。有可能形成取代产物或消去产物。[这里我不明确底物和底物的单位。
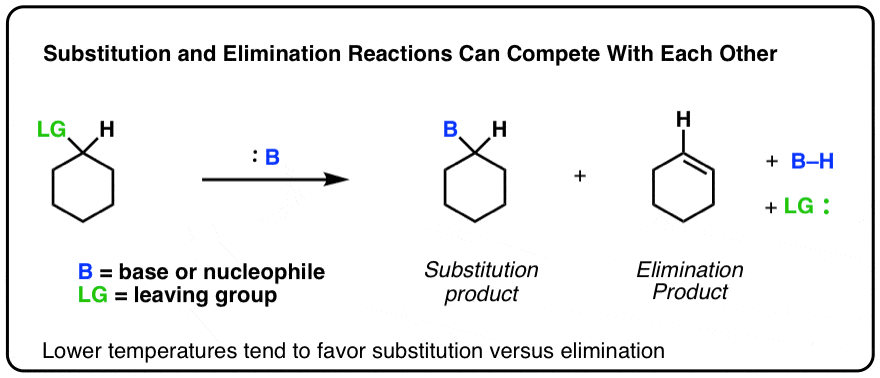
随着温度的升高相对数量的消除产品将增加相对于替代产品。你可以想象它是这样的。
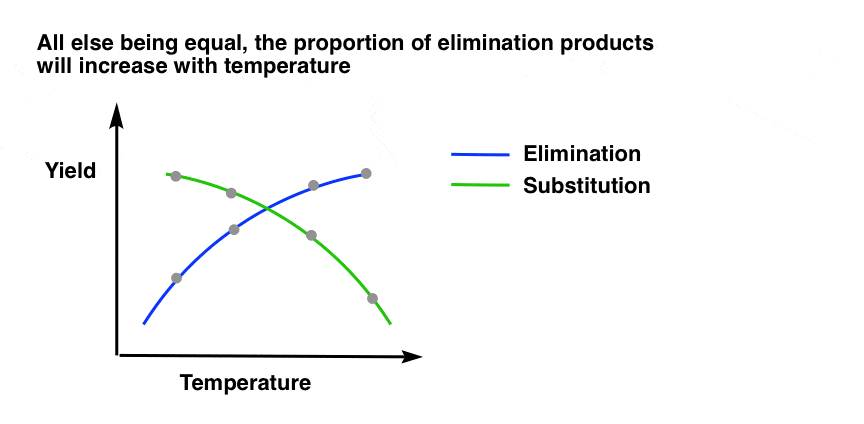
2.加热导致消除比取代逐渐增加
再看看有机化学是如何运作的。并不是说加热是一个开关能让反应从100%取代到100%消除。相反,升高温度会导致a循序渐进的消除产物相对于替代产物的增加。这是因为温度逐渐导致消去速率常数与替代速率常数的增加。
这是怎么回事?
有一件事我们可以自信地说:在低温,活化能为取代反应比这个低吗消去反应。记住,越低活化能反应速率越高。这可能有助于解释产物的分布:当我们提高温度时,更多的能量可用,因此起始物质也可以上升活化势垒来提供消除反应。这与观察到的情况相符。
然而,还有一个更根本的原因,为什么随着热量的增加,我们可能会看到更多的消去产物,这与我们所知道的热力学的一些性质有关,这些性质使速率常数(和活化能)与温度有关。
3.消除反应导致溶液中物种数量的增加;取代反应则不然
让我们再来看看(一般的)反应:
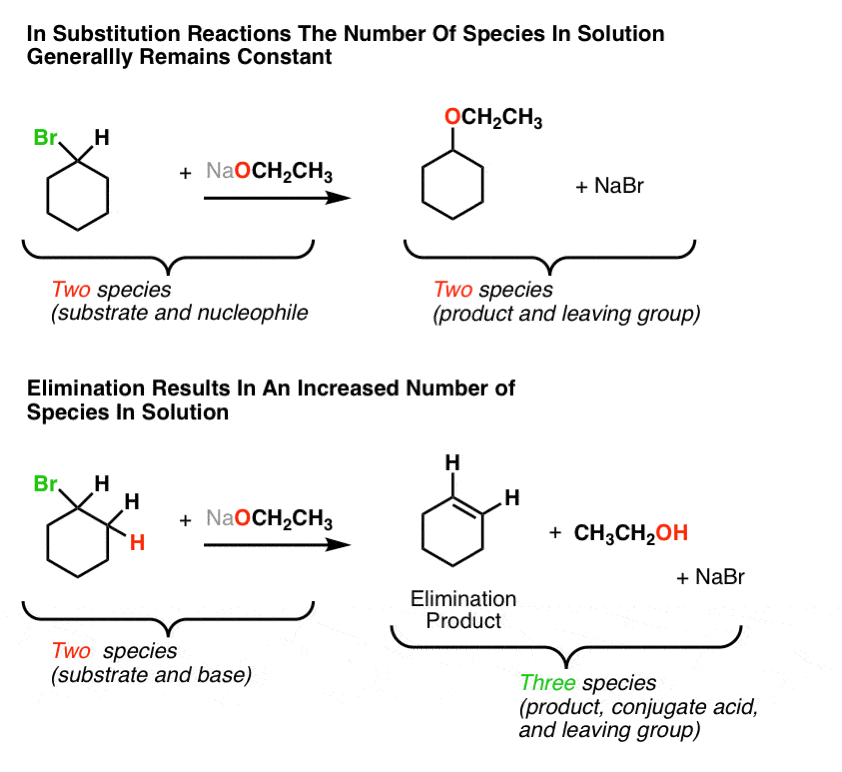
我们注意到了什么?注意取代反应我们从原料中的两种物质变成了产物中的两种物质。但是在消去反应,我们从原料中的两种物质变成了产品中的三种物质。增加!
4.溶液中物种数量的增加意味着更大的熵,这意味着吉布斯方程中的-TΔS项随着温度(T)的增加而增加
因为我们在这里的溶液中诞生了一个新物种,这将导致一个熵的增加。如果你回想一下普通化学,吉布斯方程告诉我们这个关系:
Δg = Δh - t Δs
记住ΔG越负面,反应就越有利。随着温度的升高,TΔS项会变得越来越大;这将使Δ G越来越负。在某一时刻,随着温度的升高,消去的ΔG会变得比取代的G更负。换句话说,更有利。

不过有一件事要小心!当我们讨论ΔG时,我们应该讨论的是过渡态,而不是最终产品。(为什么不呢?因为稳定性产品与反应速率无关(如果有关系,我们的身体就会燃烧成CO2和H2哦,很久以前了!)]。我们给过渡态的热力学术语一个特殊的名称我们给它们加上一个小的双匕首。ΔG‡。吉布斯活化能就是我们定义的活化能反应的。
通过分析这一项,你可以看到活化能可以随温度变化!
在低温下,取代活化能(ΔG‡)的能量比消除活化能低(更负)。但在高温下,消去的吉布斯活化能(ΔG‡)开始为较低的比取代反应的能量少,因此我们得到了更多的消除产物。
ΔG‡‡=ΔH - tΔ年代‡
再一次。最重要的是,在其他条件相同的情况下,热量倾向于有利于消除反应。
笔记
(高级)参考资料和进一步阅读
- 消除反应的机理。第七部分。单、双分子取代消除反应中溶剂对反应速率和产物比例的影响烷基羟基溶剂中的卤化物和磺酸盐
库伯、达尔、休斯、英戈尔德、麦克纳尔蒂、伍尔夫
j .化学。Soc。1948, 2043 - 2049
DOI:10.1039 / JR9480002043 - 消除反应的机理。八世。温度对单分子和双分子取代消除反应速率和产物比例的影响烷基羟基溶剂中的卤化物和磺酸盐
库伯,E. D.休斯,C. K.英戈尔德和B. J.麦克纳尔蒂
j .化学。Soc。1948年,2049 - 2054
DOI:10.1039 / JR9480002049
这是关键论文。Ingold说:“[..]对于任意一对同时发生的双分子过程,在每个研究案例中,消去反应的激活能都比伴随的取代反应高1-2千卡/g.-mol。因此消去总是有较大的温度系数,因此温度的升高增加其中的比例烯烃形成。” - 消除反应的机理。第10部分烯烃消除从异丙基、仲丁基、2-正戊基和3-正戊基溴在酸性和碱性酒精介质中
M. L.达尔,E. D.休斯,C. K.英戈尔德
j .化学。Soc。1948, 2058 - 2065
DOI:10.1039 / JR9480002058
这是热量对排除法影响的一个很好的例子。本文表一表明,2-溴丁烷与1 M NaOEt在乙醇中溶解得到82%的产率烯烃在25°C,但类似的溶解度在80°C, 91.4%的产率烯烃。
你好!谢谢你发了这么好的解释文章。不过,我对你的一项陈述有疑问。你说过温度的升高会降低活化能。我认为温度实际上并没有降低活化能,而是增加了碰撞频率和阿伦尼乌斯方程的能量因子,这样做,增加了速率。我以为唯一能降低活化能的是催化剂。
优秀的点。你说得对,我会解决的。
这个错误被修复了吗?
我移除了之前在那里的一个图形。
嗯,我糊涂了。也许这是因为文本关注的是反应的DeltaG,而实际上它都是关于DeltaG‡?正如我所看到的,有一些根本的区别,比如取代反应的delta ~0和消除反应的delta >,对于这两个反应,‡都是*负的。这就意味着,当温度升高时,delta‡实际上具有更强的正电荷,这将减缓两种反应。但这不是我们在实验中看到的。我们如何理解这一点呢?
此外,如果我们想解释热倾向于消除的观察结果,我想我们必须证明delta‡在消除时的负系数要小于替换时的负系数。我们能确定情况就是这样吗,仅仅通过比较两个反应的δ并注意到消去反应的δ更正吗?我并不完全相信。也许你能帮我?
我明白消去过程由于生成物种类数量的增加在熵上更有利,但如果你说我们应该只考虑过渡态的ΔG它们不都只形成一个“过渡物种”吗?为什么熵的推理适用于过渡态?
*Both表示两种反应
**我想问的是,如果我们只考虑过渡态的活化能(而不是生成物),为什么文章主要讲的是生成物的ΔG ?
这对过渡态也适用吗?(消除反应的过渡态也比竞争的SN反应包含更多的物质)
比如,你能不能拿2-溴-3-乙基戊烷用氢氧化钠处理(在-78度)得到大部分的2-醇产物而不是-烯?
我想你会发现在这个温度下反应非常缓慢。如果只限于NaOH作为亲核试剂,尝试得到取代的一个更好的方法是尝试用相转移催化(18-crown-6)与NaOH在极性非质子溶剂中在较低的温度下。
非常感谢你的这些文章——它们是如此的有用,清晰,容易理解,因为我正在为期中考试学习!!
太棒了,谢谢你让我认识塞布丽娜!
你好,我不太明白第二篇研究论文中提到的单位“千卡/g-mol”,你能解释一下吗?
非常清楚的解释,谢谢你,先生