光谱学
介绍了紫外可见光谱
最后更新:2022年10月31日|
了解紫外可见光谱将会让你在派对上更有趣
在今天的文章中我们将讨论为什么大多数分子都无色,介绍紫外可见光谱的有用的技巧,最后解释为什么分子像叶绿素和β-carotene彩色。
我们甚至会完成通过展示如何使用紫外可见光谱预测分子的颜色,这是一个伟大的技巧推出在聚会。不,说真的,这是不可思议的。我们讨论了解化学的颜色,每个人!它不会比这更好。
首先,总结。我们会走过下面的细节。
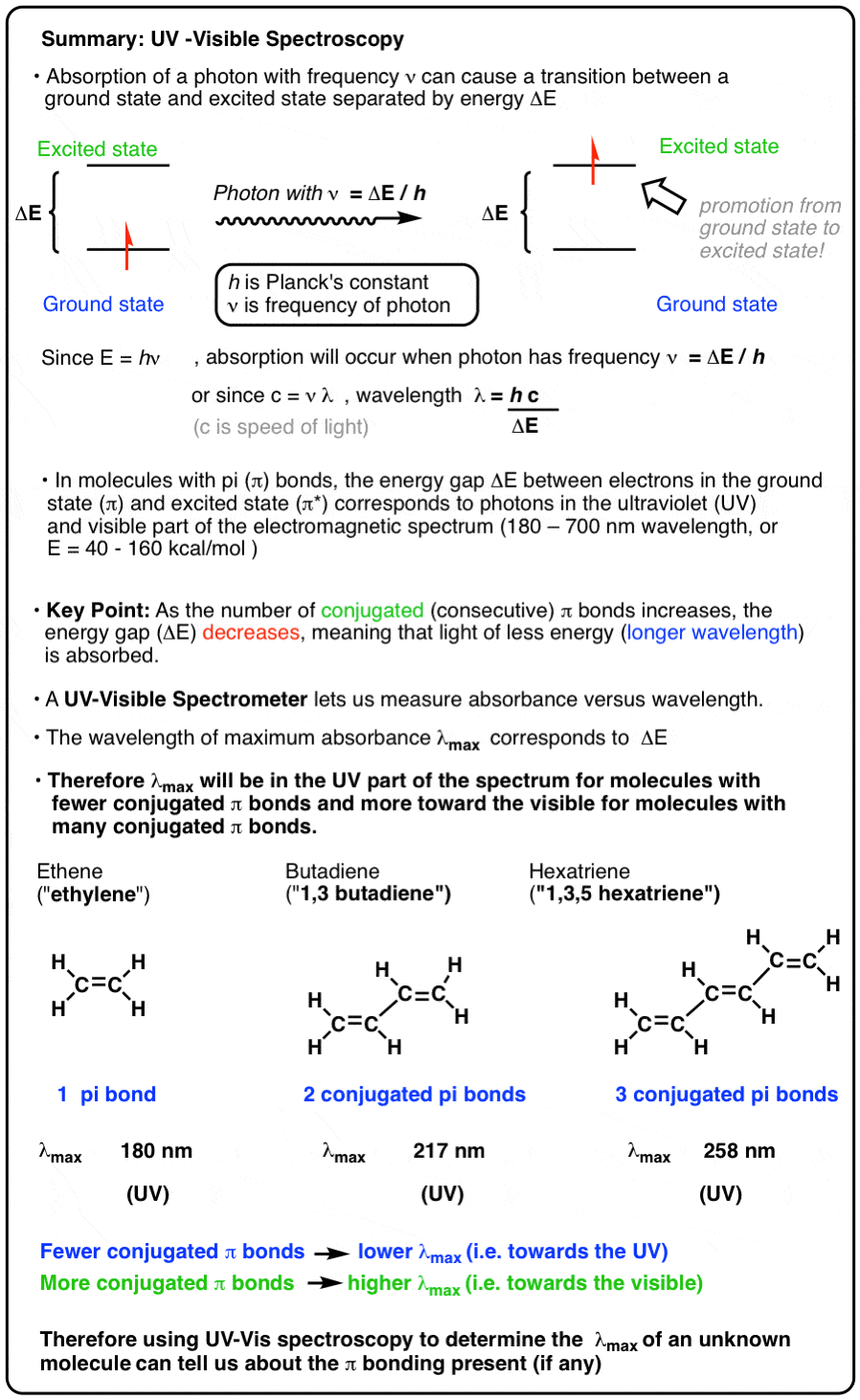
表的内容
- 频率的单位转换成能量单位
- 可以晋升为基态电子激发态吸收的光
- 案例研究:H2分子轨道图
- 为什么大多数分子只包含单键无色吗
- π键吸收较长,更加积极的波长访问
- 紫外可见光谱仪
- 共轭π键的如何影响λ马克斯?
- λ马克斯与我们感知的颜色吗?
- 结论:紫外可见光谱
- 笔记
1。光的频率转换成能量单位
如果你想让某人读你写的东西,从一个方程通常是一个坏主意。不过,我们要开始一个最美丽,神奇,平原有用的方程的科学。所以如果你下降后读这篇文章,真的,那是你的问题。
从普通化学,你可能记得不朽的方程
E =hν
在哪里E是能量,h普朗克常数(6.626×10-34年米2公斤/ s)ν频率(m1)。
为什么这个方程是如此该死的有用吗?因为它涉及能量光的频率。
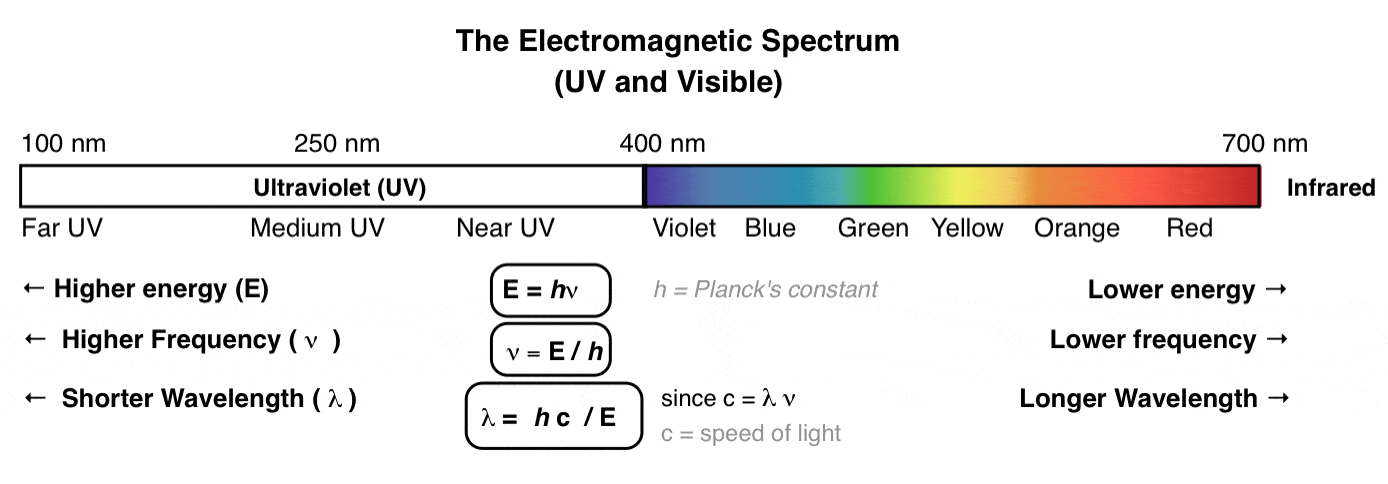
更具体地说,当我说“光”我的意思是,“光子”,如航母的电磁辐射。为了今天的帖子,这里的一部分电磁波谱今天我们将讨论:紫外和可见的频率。
2。可以晋升为基态电子激发态吸收的光
在普通化学(玻尔的氢原子模型,有人知道吗?)你看到一个电子可以提升的基态轨道的激发态轨道通过吸收一个光子的频率:
ν=ΔE /h
(其中ΔE是基态和激发态之间的能量差异)。
因为它是一个电子被从一个能级提升到另一个地方,我们称这些“电子转换”。一般来说,电子辐射的频率需要转换的紫外和可见的部分电磁波谱。
这有实际的重要性在许多方面,但是对于我们的目的,我们将会看到,最突出的是,光可以促进电子成键轨道反键轨道,因此可能导致化学键的打破。
这将帮助我们理解:
- 为什么首先分子吸收紫外线(σ- >σ*转换)
- 为什么紫外线辐射是极其有害的(特别是远紫外辐射)
- 最终,为什么某些分子颜色(π- >π*转换)
让我们先从最简单的分子,氢(H2)和构建。
3所示。案例研究:氢分子的分子轨道图(H2)
有机化学课程的一开始,你可能看到原子轨道重叠形式分子轨道。
在氢(H2),例如,两个1原子轨道重叠,形成两个西格玛(σ)分子轨道。轨道的数目总是守恒:自从我们开始两个原子轨道,我们得到两个分子轨道。
有建设性的重叠导致的形成较长的西格玛(σ)轨道。具有破坏性的重叠会导致更高的能源西格玛恒星的形成(σ*)轨道。这两个轨道能量不同ΔE。
因为每个氢原子带来一个电子参加晚会,我们有两个电子填满我们的分子轨道,能量较低的轨道,他们会填满第一——就像没人如何选择站在过道上的城市客车(能源)当存在一个空的座位(低能量)。
这给了我们一个这样的图:(如果你发现这令人生畏,只关注红色ΔE)。
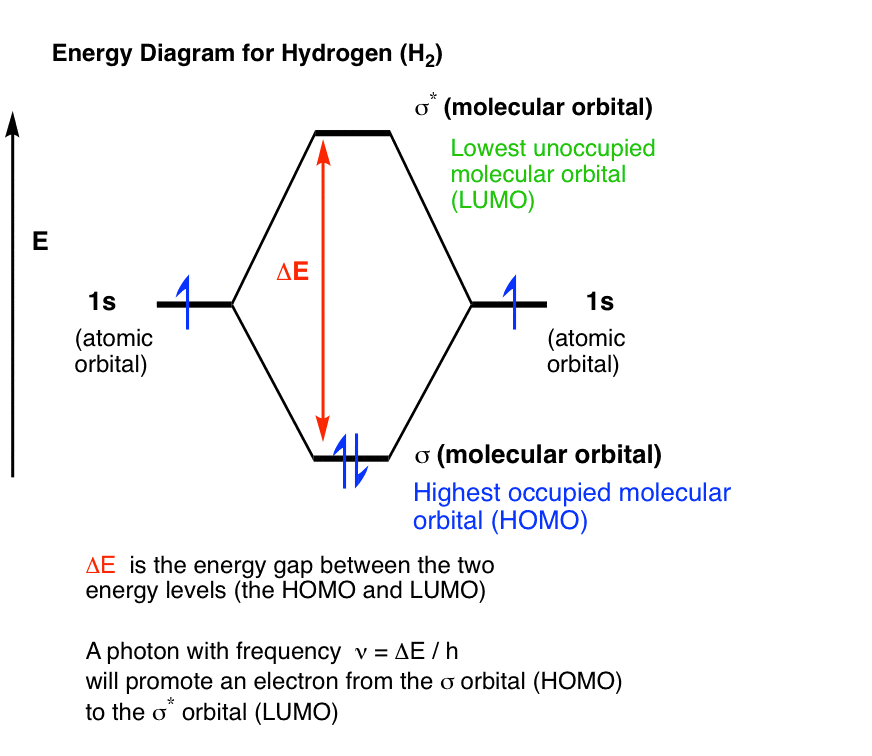
那ΔE波尔模型是很重要的:通过类比,如果氢分子(H2)暴露在光的频率
ν=ΔE /h
一个电子从基态提升(σ)分子轨道(最高占据分子轨道,或HOMO)激动的σ*分子轨道(最低未占据分子轨道或LUMO)。
这有点像小孩爬楼梯,一步一个脚印:一只脚的提升占据最高的一步到最低未占据的步骤,所需的能量是由步骤之间的高度差。
现在,我们可以通过方程转换频率,波长
c =νλ(c是光速,波长λ)。
高度差的债券的H2,ΔE对应一个测量的最大吸收波长112海里深,深,深在紫外区域的电磁波谱。
4所示。为什么大多数分子只包含单键无色吗
112海里不是日光浴床的紫外线。不,这是死光紫外光谱的一部分。这是因为紫外线辐射低于120海里也是常见的σ键碳氢键和碳碳吸收,因此接触远紫外光线会很快片段债券组成的蛋白质,糖,和DNA存在于我们的身体,使我们感伤。
让我们使这个更清楚。
大多数单(即σ)债券,如碳碳碳氢键,地,切断ΔE值对应光在深紫外光谱的一部分。出现无色因为光线在可见区域(400 - 700 nm)根本没有足够的精力去激发他们的成键电子激发态。
这就是为什么水是无色的。这就是为什么乙醇是无色的。这就是为什么乙醚、己烷、氯仿和许多其他分子你遇到在实验室和在日常生活中都是无色:成键轨道的ΔE太大相对低能光子的可见光激发他们。(插入杰布·布什笑话?)
事实上,紫外线在该地区低于120纳米是如此精力充沛,这是完全被大气吸收O2和N2。换句话说,如果你想测量的波长,说,乙醇吸收,你需要把它在一个真空室,暴露紫外线。这是学术兴趣,当然,但一个典型的介绍课程的范围之外。对于我们的目的,我们不会进一步讨论σ→σ*转换。
底线:我们通常不观察σ→σ*转换。
(一个例外,我们遇到dihalogens像Cl2和我2可以吸收可见光通过的σ键均裂产生自由基。这是一个打破σ键通过吸收紫外线或可见光,成为可能,因为这些债券相当疲弱,大约50 - 60千卡每摩尔,相应的ΔE很小)。
5。π(π)债券吸收较长,更容易获得波长
好:我们要忽略σ→σ*转换。所以让我们来谈谈π-π*转换。
这是有趣和相关的。
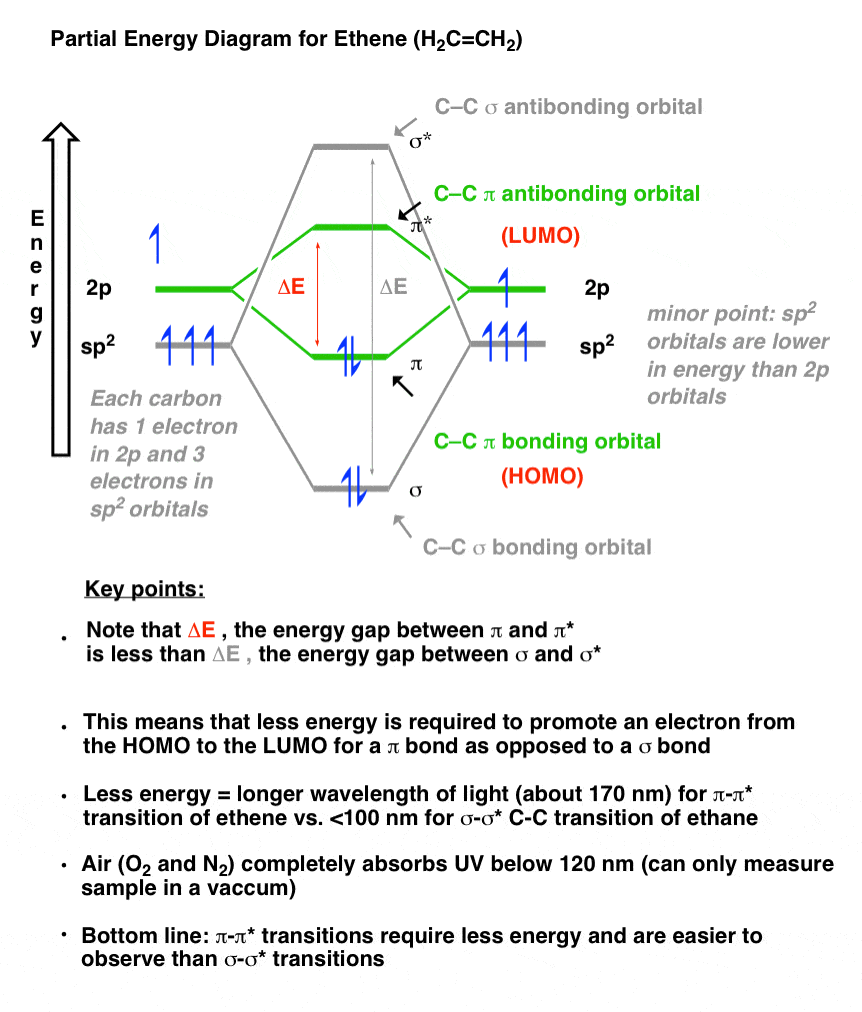
让我们提醒自己我们讨论的开始用一个简单的分子。这是乙烯(或称“乙”),最简单的烯烃。快速浏览一下它的结构5σ键和一个π键。
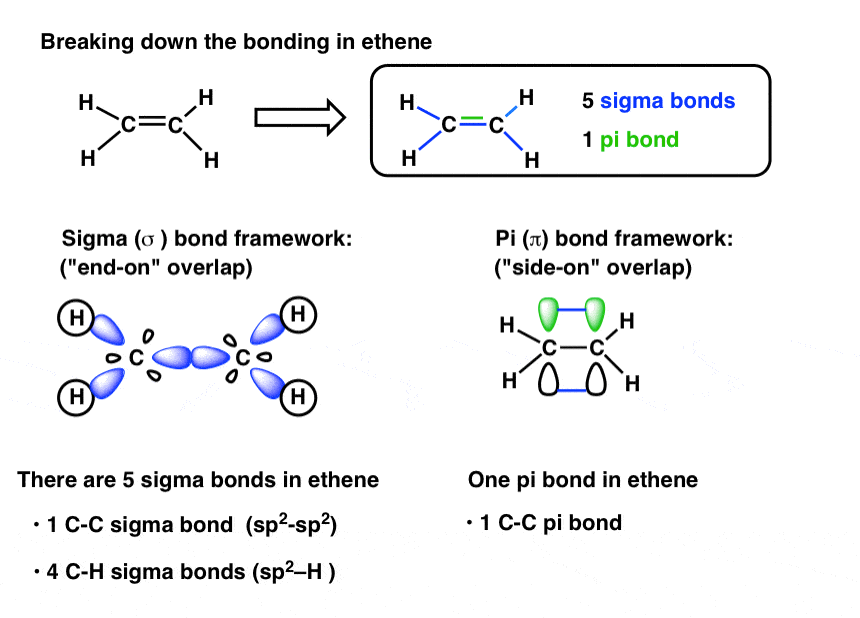
- 回想一下,σ键的结果“在端点的”重叠或spn(sp, sp2或sp3)轨道,而π键的结果“副作用”结合相邻p轨道。
- 在其他条件保持不变的情况下,π键较弱的比类似的σ键,因为更少的轨道重叠。
- 较弱的债券意味着之间的能源缺口ΔEπ(人类)和π* (LUMO)将相应小。(在我们的类比,更短的一步爬楼梯需要较少的能量)。
- 由于ΔE小对于一个π键,这对应于一个长波长(较低的频率)需要激发电子从ππ*轨道。
乙烯,介子*过渡的最大吸收波长约为170纳米。仍然在深紫外线,但不如相应的碳碳σ键的极端。
我们期望乙烯无色,它是:它只吸收有点接近光谱的可见部分,乙烷。
让我们用图来说明经常看起来可怕的学生:一个轨道能量图。
*触发警告*图试图表明这一切ΔE碳碳π键(在绿色)小于ΔE碳碳σ键(在灰色)。如果你得到,你抓住了关键。*
等一下,你可能会说。我们如何知道乙烯吸收光在170 nm紫外线吗?
很高兴你发问。让我们介绍一个非常重要的设备称为紫外可见分光计。
6。紫外可见光谱仪
的基本思想紫外可见光谱发光是不同波长的光通过一个示例和测量每个波长的吸光度。只有相对应的波长ΔE电子转换将会强烈吸收。(示意图的光谱仪是如何工作的:检查这个优秀的页面,这也是另一个很好的解释的紫外线。
紫外可见光谱图吸光度(或它的逆,透光率)的样本和波长。这是乙烯的频谱。(在这种情况下,波长是策划和透光率,吸光度的倒数(高吸光度=低透光率,反之亦然)。]
请注意,波长的最大透光率在174纳米。我们称之为λ马克斯,明显的“λ马克斯”。很少的光通过样品在这个波长,因为波长密切对应ΔEππ*跃迁。
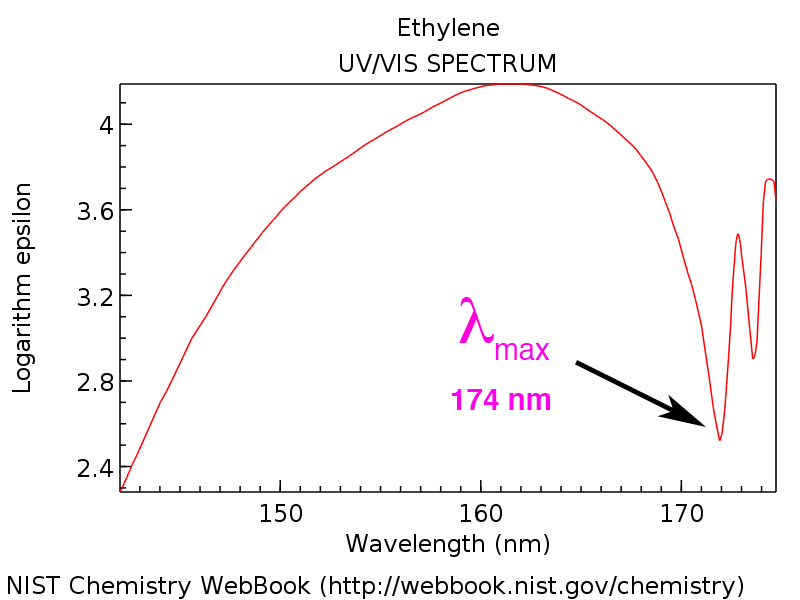
紫外可见光谱仪是一个有用的工具,因为它允许我们确定确切位置样品吸收光线,因此量化电子转换。例如,知道λ马克斯乙烯在174 nm允许我们来计算能源缺口ΔE,大概是164千卡每摩尔。
7所示。λ共轭π键的影响如何马克斯吗?
在我们的以前的文章在天然色素,我们注意到他们大量的共轭π键负责他们的颜色。
紫外可见光谱法可以帮助我们理解如何结合与λ有关马克斯分子,因此,它的颜色(或缺乏)。
例如,让我们来看看发生了什么λ马克斯当我们增加共轭长度从1(乙烯)2(丁二烯)3 (hexatriene)。
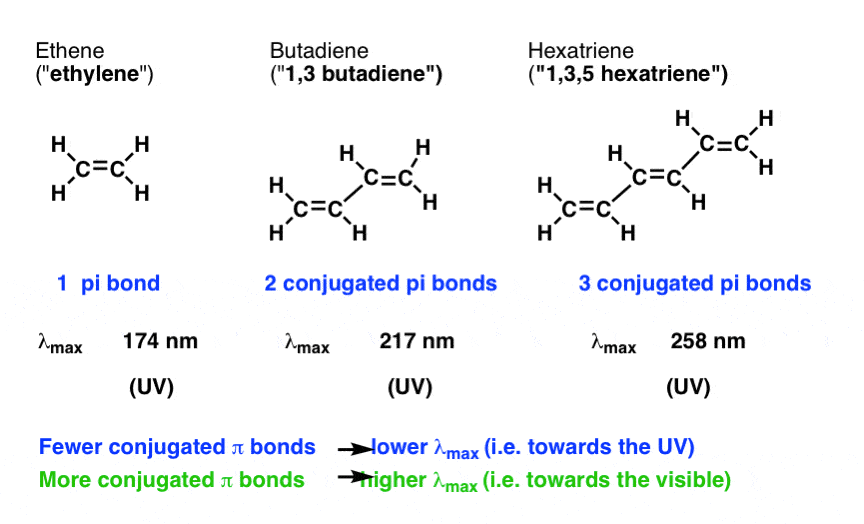
随着共轭π键的数量增加,λ马克斯增加!
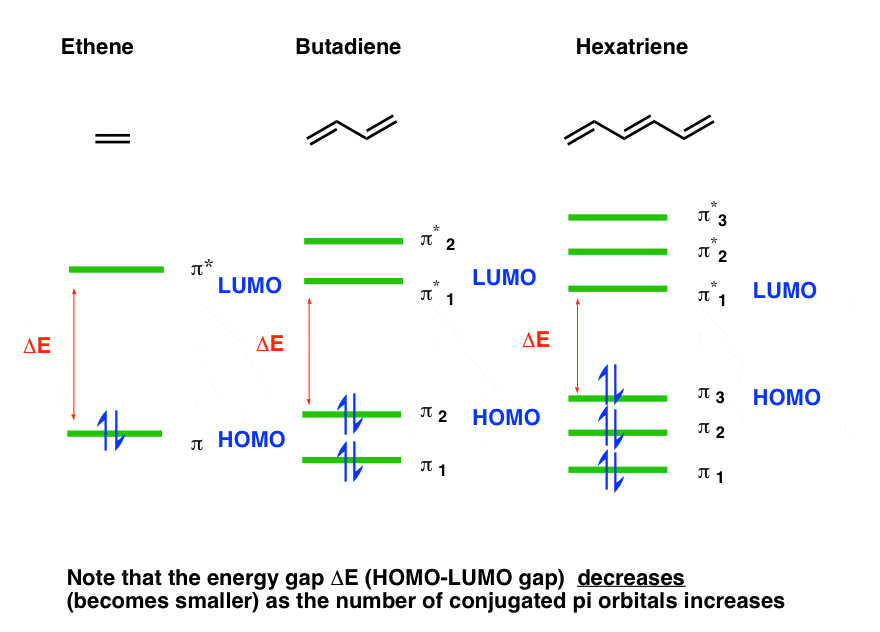
因为时间频率=能量小,这意味着能隙ΔE之间的最高占据分子轨道(人类)和最低未占据分子轨道(LUMO)减少作为共轭π键的数量增加。
为了好玩,这就是成键情况(大约)的样子。同样,只关注ΔE:它变小共轭π键的数量增加。
随着这一趋势的继续过去hexatriene向分子共轭长度更长,λ马克斯开始蔓延到光谱的可见区域。它已经在258 nm的共轭长度3。颜色时开始出现共轭长度方法7左右。(例如,两性霉素B7共轭π键和吸收约403海里,紫罗兰。)
我们的老朋友番茄红素(λ马克斯471海里),β-carotene(λ马克斯452海里),叶黄素(λ马克斯445海里)有更大的π系统(10 - 11)和吸收可见光进一步向红。(注2]
因此,的λ马克斯分子在很大程度上是一个函数的共轭长度:随着共轭数量增加,λ马克斯。
但是还有一个问题:
8。如何λ马克斯与我们感知的颜色吗?
最后一块拼图。如何最大吸光度的波长(λ马克斯)与实际联系起来颜色吗?
首先,的复习。我们看到的主要颜色的互补色是吸收。一个分子的吸收蓝色的将会出现橙色,因为我们感知的颜色反映了,橙色是蓝色的补色。
例如,这个分子,罗丹明B (注3]吸收约560海里(绿色),出现红色的绿色的补色。
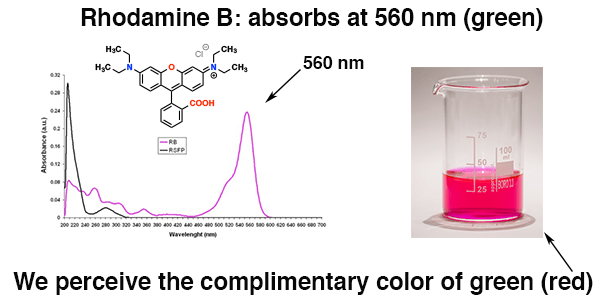
知道分子吸收可见光允许我们对颜色做出预测。有趣!
这是一个相当坏蛋鸡尾酒会,我想。想想,下次你看一片叶子,一个西红柿,胡萝卜,或黄色小龙虾的血。
我们可以继续(我们会)。但现在让我们离开这里。
顺便说一句:一个神奇的治疗的紫外可见光谱jibber-jabber一直写的少蒂姆·索德伯格LibreText。检查一下。
同时,紫外可见光谱Reusch在线教科书的条目深入详细地更深入和更丰富的比这篇文章是关于这个主题。
9。结论:紫外可见光谱
这篇文章已经走过的一些理论背后的紫外可见光谱。
在下一篇文章中,我们将进入紫外可见光谱的一些更实际的方面。什么样的问题更能帮助我们回答一个未知的分子呢?
笔记
的λ马克斯不是仅仅π键的数量的函数。如果这是真的,番茄红素(11个共轭π键)和β-胡萝卜素(也有11个共轭π键)就会完全相同的颜色。他们不会,因为λ马克斯也受取代基如附加的影响烷基组,π键是否内部或外部环(内环的/环外的)和杂原子。
早在1940年代,实际上,只有当紫外可见光谱方法可用,伍德沃德和费塞尔(开发一组经验规则Woodward-Fieser规则),旨在预测λ马克斯基于一系列的结构性因素。这些规则对于更复杂的共轭系统的变异也存在(Fieser-Kuhn规则)。
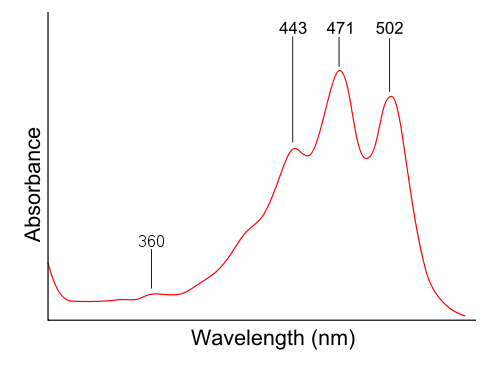
注2。我喜欢使用天然色素的紫外可见光谱番茄红素和叶绿素等例子,但它们包含不止一个最大值。这不是容易解释。因此,不如直接转化为一个颜色罗丹明B。这是番茄红素,例如(来源:维基百科)
注3。也失踪的这是为什么紫外可见光谱是广泛的,而不是直线。说,例如,如果,罗丹明δE对应于560海里,为什么它还在559和561海里吸收光线吗?答案的一部分是,债券是在不断振动和这个调整值δE,这一系列的能量吸收。
注意4。(我们可以借此多远?你在最极端,石墨烯,也就是一个大平面共轭π体系几乎无限数量的共轭π键。在这种情况下几乎所有波长的光介子*对应于某种形式的过渡,而结果是黑色的颜色。)
优秀的文章,很喜欢刷新这个基本知识。
谢谢你!
爱你的帖子。电磁波谱图中,波长和频率切换的符号。
谢谢你!固定! !
非常聪明的点。非常感谢。我学到了很多的含义,我很困惑。概念被组织所以光泽和清晰。顺便问一下,你能解释一下关于n个成键电子,吗?
有趣的文章。简单却很丰富。
谢谢你的帖子!请注意,频率的单位是1 / s不是1 / m(你介绍了不朽的E =高压)。
开枪。谢谢你的位置。
很棒的文章!请一个帖子伍德沃德Feiser规则!
嗨Dipesh,我可能不会因为他们现成的一个高级主题,说实话。但是谢谢你的评论。詹姆斯
好的信息。关于紫外线
你是最好的有机化学家,在一个简单的方法来解释一个复杂的主题