消除反应
E1cB -消去(单分子)共轭碱
最后更新:2022年12月2日|
- 的E1cB(单分子,消除共轭碱)机制是消除反应的第三种机制途径。
- 在许多方面,它与E1机制,如第一个一步是去质子化形成碳原子,然后消除第二步。
- 它偶尔会出现在有机化学入门课程中,特别是在醇醛缩合,芳炔形成,消去卤代烷烃,生成炔.
目录
- 消去生成烯烃:E1和E2途径
- E1的cB机制
- E1cB机制和E1机制是两个极端,E2机制处于中间
- 有机化学导论中E1cB机制的例子:醛醇缩合
- 另一个例子:卤代烷烃形成炔烃
- 卤化苯基烃的形成
- E1cB反应坐标图
- 总结:什么时候反应可能通过E1cb机制?
- 笔记
- (高级)参考资料和进一步阅读
1.消去生成烯烃:E1和E2途径
消去反应是我们学会的最常见也是最有效的方法之一烯烃(碳碳PI键)从烷基卤化物。
在产生新的碳碳π键的消除反应中,总是观察到相同的成键和断键的一般模式!
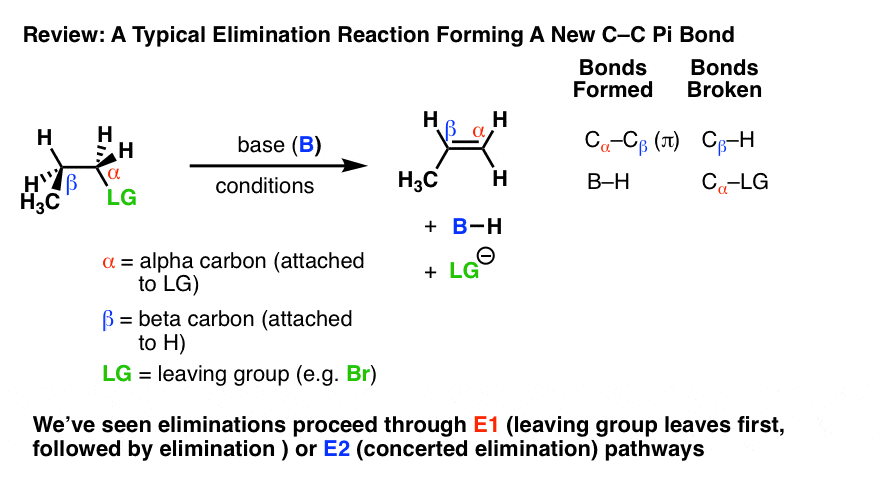
大家都同意什么发生了。然而,我们真正想知道的关键问题是如何这是真的吗?”
编剧们知道这一点。他们总是会透露电影的结局——通常在开场前5分钟。但让你继续看下去的是试图理解事情是如何发生的。如果人们已经知道阿纳金最终会成为达斯·维德,为什么还要坐着看六个小时的电影三部曲呢?]
这些键形成和断裂的顺序就是反应的“机制”,或者你也可以说是反应如何发生的“故事”。
我们已经看到两个到目前为止需要消除的这些模式:
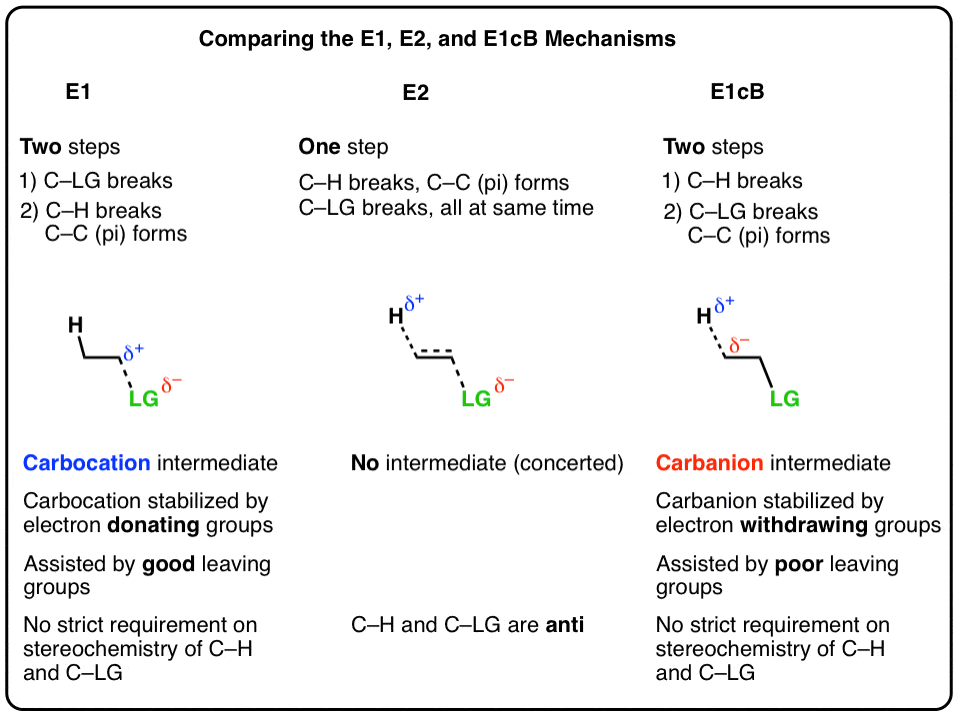
- 在E1机制,消去发生在两个步骤.C-LG键首先断裂,留下一个碳正离子。这是慢一步.在第二步中,一个碱使碳脱质子,打破C-H。碳氢键上的孤对电子和碳正离子上的空p轨道形成了新的键。速率定律是单分子的(因此E1),因为它只取决于基底。
- 在E2机制, C-H键和C-LG键断裂同时新的碳碳键形成了。这是一个协同机制.速率定律是双分子的(因此E2)因为反应速率既取决于碱的浓度,也取决于底物的浓度。
实际上还有第三种可能性,这也是我们今天要讨论的。
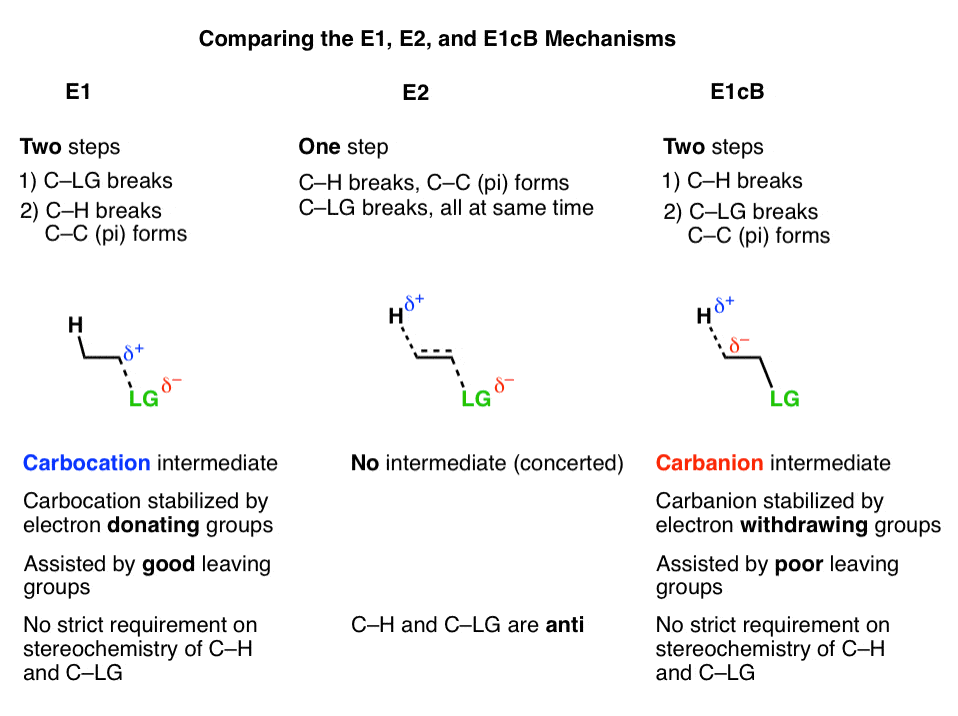
2.E1的cB机制
第三种可能是碳先去质子化(形成B-H,打破C-H)。在极限情况下,它会给出an阴离子中间,“共轭碱的基板。(参见:有机化学中的酸碱反应]
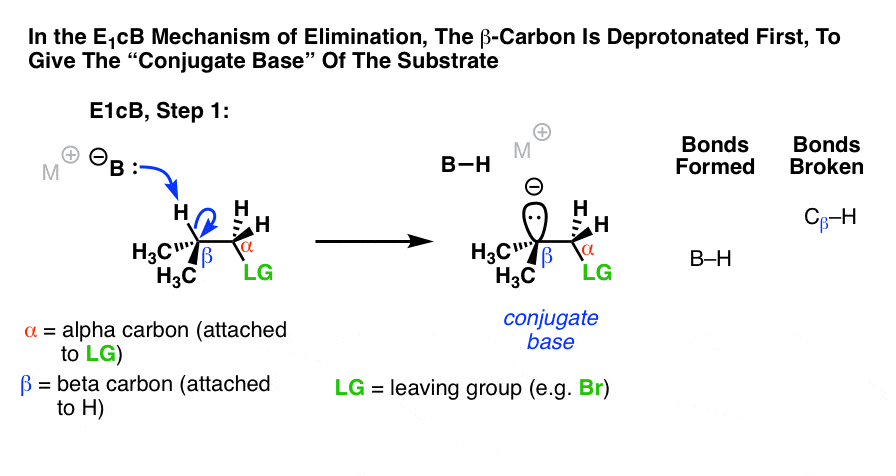
因为第一步是去质子化得到一个阴离子,那么你的猜测是正确的当碳氢键相对酸性时,这种机制更容易发生,就像α碳是不是和a这样的吸电子基团相邻酮,腈(CN),或硝基(NO2).这些基团稳定了负电荷。(参见:使负电荷稳定的因素]
在第二步,电子对来自共轭碱然后替换离去基团,形成π键[形成C-C pi,打破C-LG]。
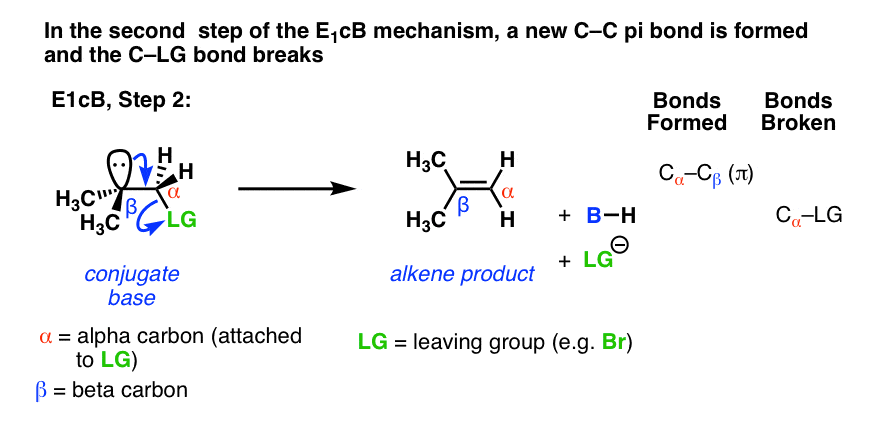
的(许多)案例中E1cB第二步是慢步,你可以想象这一步会因为一个相对较差的离去基团像(HO-), (CH3.O-),甚至(信不信由你!)注1].
3.E1cB机制和E1机制是两个极端,E2机制处于中间
这有助于我们思考E1cB机制及E1机制是两个极端,或镜像,而E2正好在中间。这有点像“辞职”和“被解雇”之间的连续体,“双方同意分道扬镳”在中间的某个地方。
- 第一步E1机制是损失a离去基团(打破C-LG)给一个碳正离子中间的,当邻近有给电子基团时,这一步被推进α碳(使碳正离子更稳定)。
- 第一步E1cB机理是脱质子(破C-H)给a负碳离子中间,这一步是促进时,有吸电子基团毗邻α碳(使碳离子更稳定)。
- 的E2机制是在这两个极端之间,所有的事情都同时发生。
那么这个机制真的发生在我们在有机化学入门课上看到的反应中吗?是的,确实如此!
4.有机化学导论中E1cB机制的例子:醛醇缩合
的最常见的例子E1cB有机化学导论中的机理醛缩合反应,特别是形成新的碳碳双键的最后一步。(看到帖子:醛醇加成和缩合反应]
下面,左边,是一个酒精加成反应.如果用碱加热(比如NaOCH3.),它失去水分,给烯烃.(失水=“凝结”)
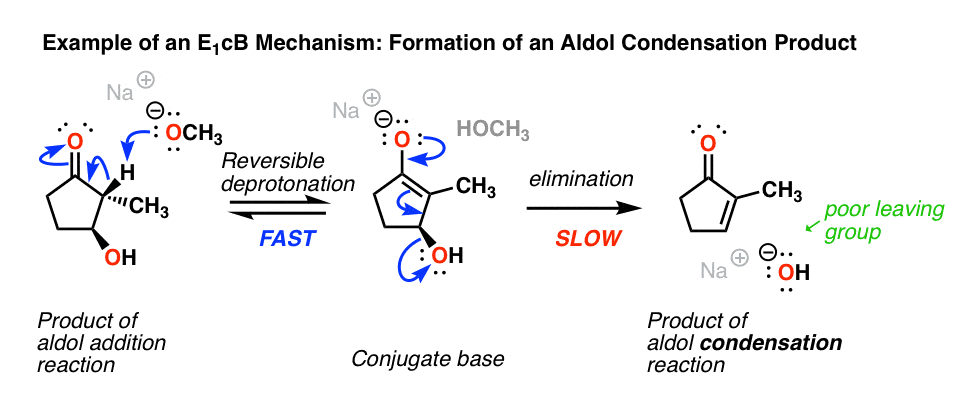
等一下你可能会说。“我认为羟基离子(HO-)是一个可怜的离去基团?这是怎么回事?”
完全正确!如果真的有好的离去基团(如OTs或Br)而不是OH, anE2(甚至E1)机制将更有可能。[注2[英语背诵文选坏的离去基团(HO-)使消去步骤为慢这是一个两步机制的主要原因。
另一个(非常微妙的)点是立体化学。如果你仔细观察,你会注意到在上面的图中,碳氢键和碳氢键并不是相互对立的(这是化学反应的要求E2),而是syn。
所以不像E2,E1cB机制并没有严格要求碳氢键和lg键是相互对立的。
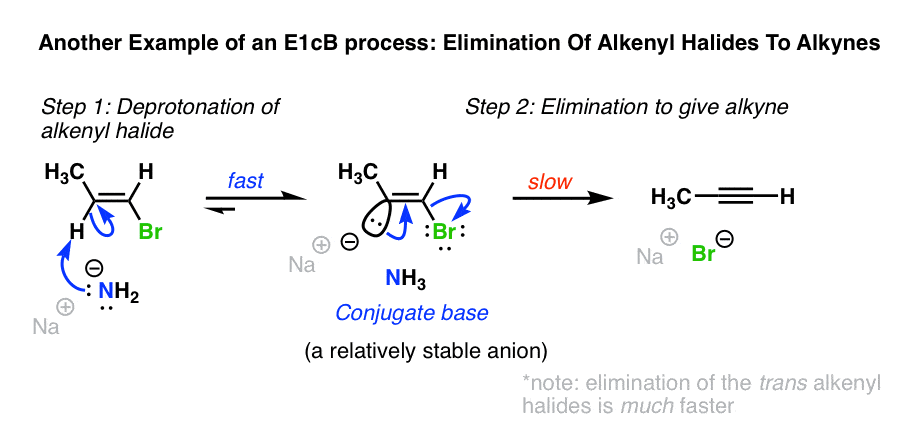
5.另一个例子:卤代烷烃形成炔烃
另一个例子E1cB是在形成的炔烃从烯基卤化物与NaNH2在液氨(NH3.).(参见:炔通过消去反应]
当烯基卤化物用NaNH处理2在北半球3.作为溶剂,消除给炔烃发生。即使H和Cl独联体对彼此来说,这似乎就排除了E2机制。[H和卤化物的消去反式不过要快得多![注3]
NaNH2是一种非常强碱。在sp2杂化了,碳氢键烯基卤化物的酸性相当强(pK一个约40),并能稳定负电荷。
在这种情况下,一个两步机制可能起作用,其中1)碳离子中间体由脱质子形成,然后是2)碳离子的损失离去基团.
6.卤化苯基烃的形成
与此相关的情况烯基卤化物E1cB可以产生的机制是在形成苄基和其他“亚炔”[参见:亲核芳香族取代-苄基机制].虽然苄基没有“真”键,但许多原理相同E1cB仍然适用。
强碱(NaNH .)对芳基氟的脱质子反应2)先发生,形成碳原子。在这种特殊情况下,第二步是损失的坏离去基团,氟。[注1]
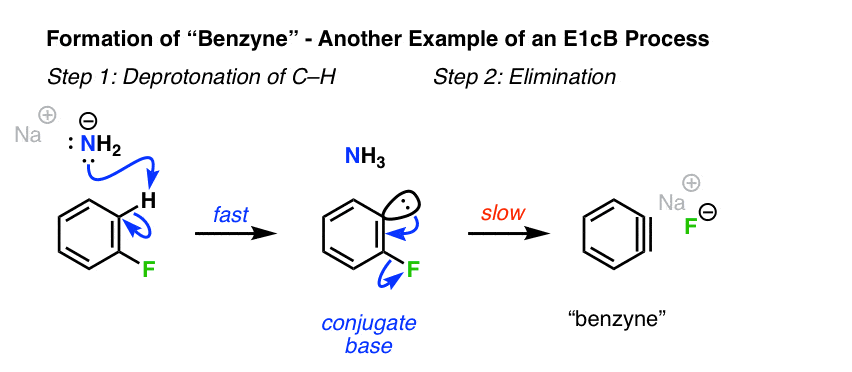
[请注意显然,当F或Cl是离去基团,去质子化是缓慢的一步。然而,当离去基团是Br或I,脱质子是决定速率的,C-X断裂快。请注意,这两个仍然符合E1cB只要反应通过碳离子中间体就行!]
7.E1cB反应坐标图
那么反应坐标图是什么E1cB看起来像什么?如果我们假设第一步要快和第二步是缓慢的(速率决定),还有一个阴离子中间,然后是反应坐标图E1cB大致应该是这样的:
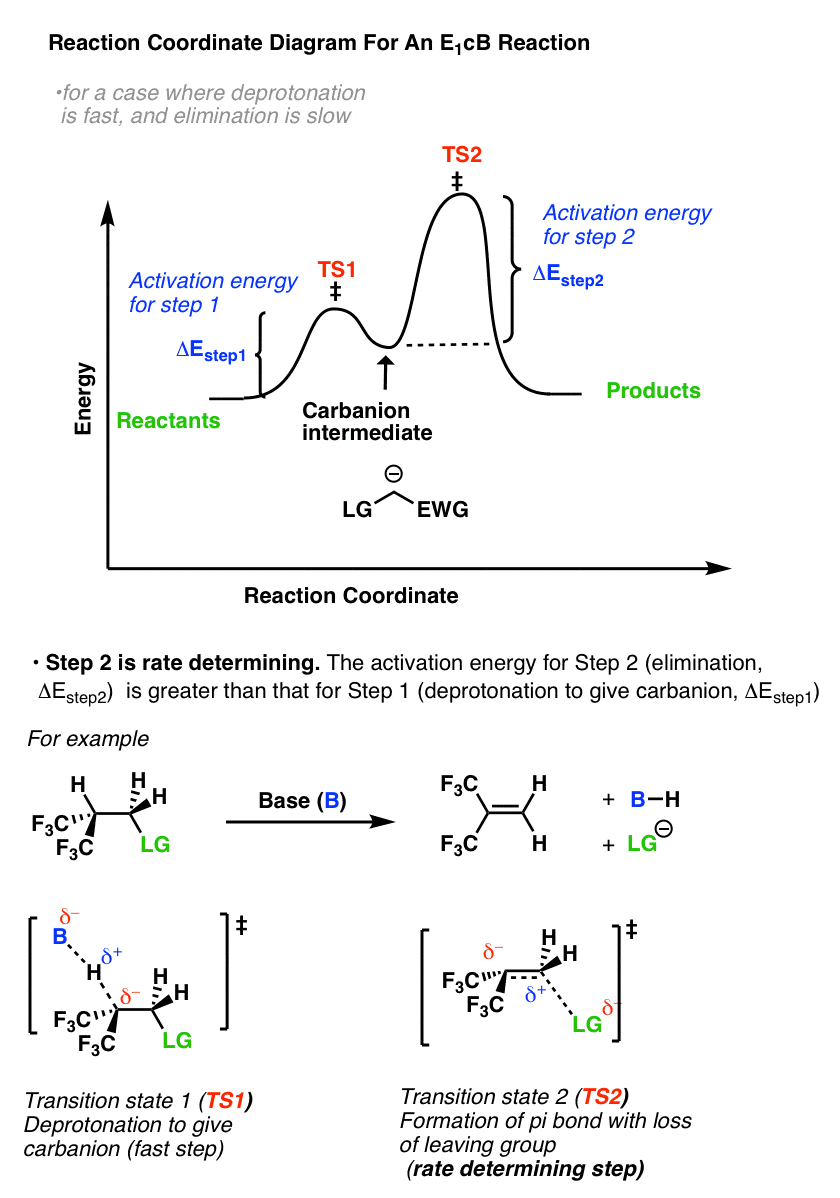
- 我们画了一个从反应物到TS的小驼峰1与活化能(ΔEStep1)等于[Δ]壹空间- Δ e反应物].
- 然后继续到阴离子中间(中间的“well”)
- 它又通过TS进行2与活化能(ΔE步骤2)等于[Δ]TS2- Δ e中间]
- 自从ΔE一步2>ΔEStep1,第二步是确定速率
将它与反应坐标进行比较E1消除,也就是镜像。
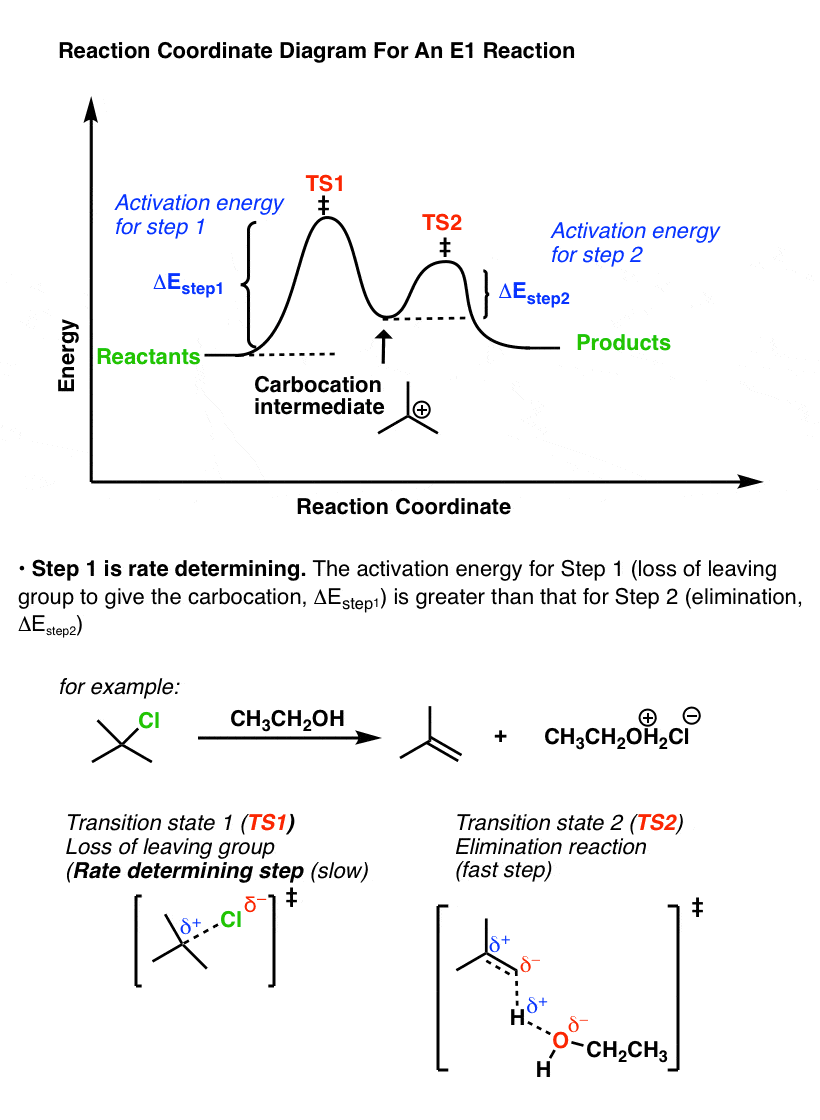
在E1机制,能量势垒(活化能ΔEStep1)的第一步(损失离去基团)高于能量势垒(ΔE步骤2)进行第二步(淘汰)。
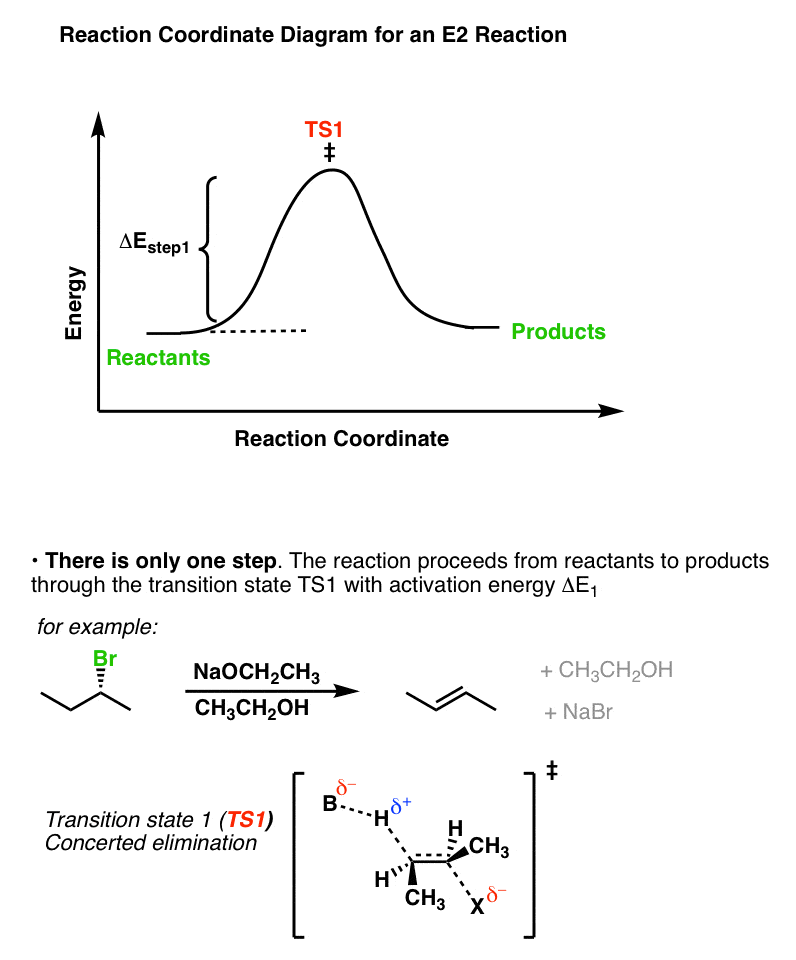
反应坐标E2Case显示这两个步骤同时发生。
8.总结:什么时候反应可能通过E1cB机制?
总结一下,在E1cB机制,消除发生在两个步骤:
的E1cB机制在有机化学入门课上并不常见,但当观察它时,预计会看到以下几个特征:
- 吸电子基团的存在有助于稳定中间体阴离子
- 一个相对贫穷的国家离去基团(这会拖慢第二步)
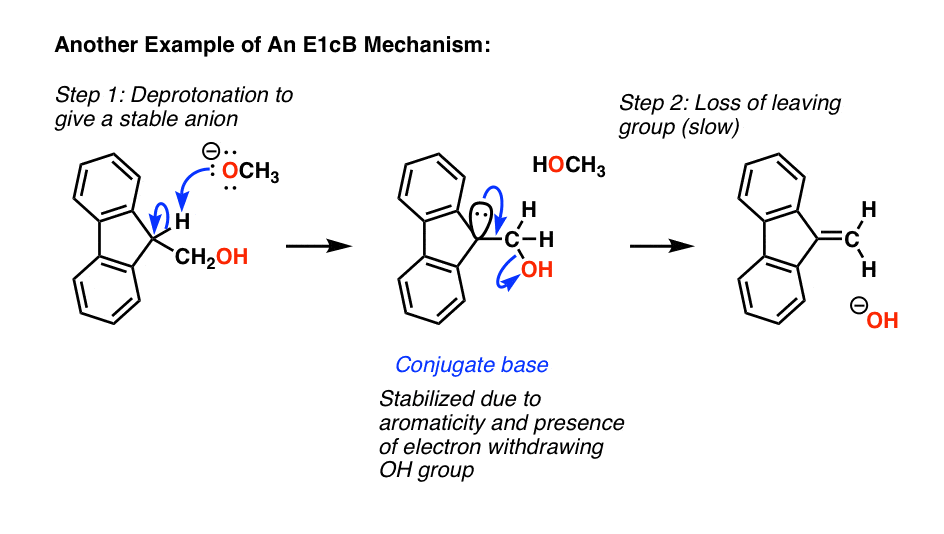
这是最后一个经典例子一个E1cB,在那里,去质子作用会导致一个非常稳定的阴离子(它是芳香)慢慢地失去穷人离去基团(氢氧根离子)形成一个新的碳碳π键。
笔记
注1。我们从来不认为F(-)是a离去基团的年代N2种反应,但在某些条件下可以是a离去基团在各种取代和消除反应中。一个例子是亲核芳香族取代这是另一个通过相对稳定的阴离子的机制的例子。
注2。欲了解更多详情,请参阅参考7,这表明在淘汰赛中有一个好的离去基团,E2即使有强的吸电子基团存在,也会发生。
注3。看到参考5- H和Br反应容易得多反式相互作用(可以用NaOH!),但当Br和H是,需要NaNH2/NH3独联体.
更多关于E1cB
[1-我们如何决定E1cBvsE2- - - - - -2〇动能同位素效应3.E1CB可逆的- - - - - -4E1CBIRR- - - - - -5E1CB阴离子- - - - - -6总结-总结三种主要口味E1CB- - - - - -7——立体化学。]
1.我们如何确定某些反应是遵循E1cB机制还是E2机制?你怎么知道它们的区别?
这是个好问题。
这些研究总是从实验观察开始,然后是实用的好奇心。例如,考虑下面的反应。参见参考文献9我们可能会天真地认为这是一个E2的反应。毕竟,有一个强碱,a离去基团(虽然可能不好)而且C-H键和C-OH键的立体化学可以相互对立。
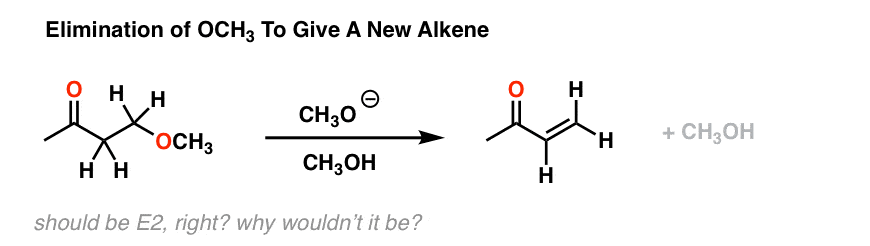
E2,对吧?然而,事实证明,如果你在氘化溶剂中进行这个反应,并中途停止,你最终会得到很多这个:
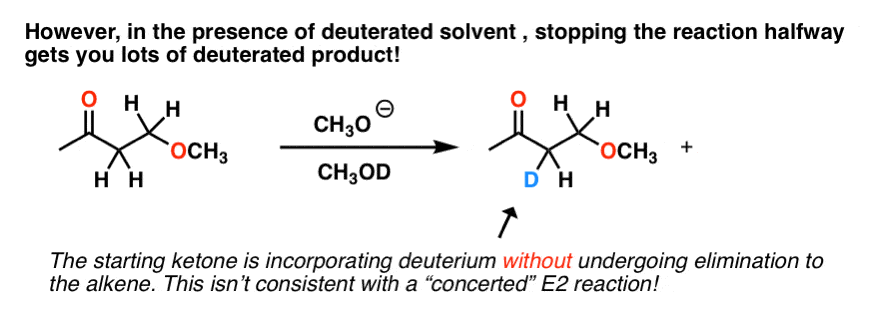
我们没有看到这个E2因为碳氢键只有在反应时才会断裂反到离去基团.
在这个例子中,碳氢键显然在断裂,但消去并不总是发生。到底发生了什么?
这里发生的最好的解释是碱形成了共轭碱的底物,这可以与氘化溶剂(作为一种酸)反应,从而产生氘交换在那个位置。
结果是交换比消去快220倍。
这很有趣。但是,重要的是共轭碱在淘汰赛?仅仅因为我们知道它正在形成证明它与排除法有关。
也许负离子的形成只是一个“死胡同”,一个缓慢的过程E2反应是形成的原因烯烃?
也许。事实上,要回答这个问题需要做很多工作。看到参考2),但阴离子形成的明确证据至少应该播下怀疑的种子E2这是唯一的可能。
2.动力学同位素效应
理论上讲,有一种方法可以区分E1cB和E2就是通过研究速率定律。事实证明,这通常是困难的情况下E1cB[看到参考1,所以化学家们不得不求助于其他方法。
研究有机反应机制的一个关键策略是测量动力学同位素效应这种方法利用了同位素之间键强度的细微差异。例如C-D (氘)键比类似的碳氢键略短(但强度更大)。如果C-H键断裂发生在速率决定步骤中,则C-H化合物的反应速率(kH)的速度应略快于氘用C-D键标记模拟物(kD).这种差异称为主动力学同位素效应,已被实验确定有一个范围kH/kD在大多数情况下大约是2-8E2.
因此,如果C-H在速率决定步骤中被破坏,那么我们应该在2-8范围内看到一个主要的动力学同位素效应。如果不是,那么两者之间应该没有区别。
对吧?
3.E1cB可逆的
在上述反应的情况下,动力学同位素效应约为1.0。这是一个明确的迹象,C-H键没有打破在速率决定步骤,这就排除了E2(共同)机制。
这些类型的E1cB反应被称为E1cB可逆的指示可逆的去质子化步骤,随后(缓慢)失去离去基团.
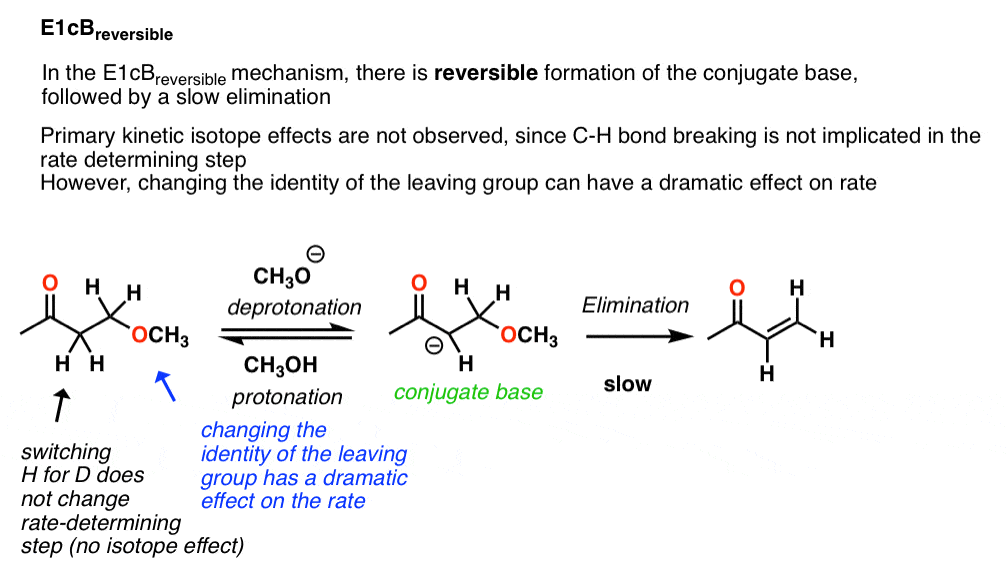
因为失去了离去基团是缓慢的,人们应该期望看到反应速率的大影响通过调整的恒等式离去基团.例如,离去基团能力可以大大修改的身份组X上苯基组(如图所示)。把X基团改成像NO2这样的强吸电子基团应该使离去基团更少的基础(和更好的离去基团),从而提高税率。事实就是这样。
4.E1cB IRR
就这样吗?只要测量动能同位素效应,我们就能分辨出E2而且E1cB?
不一定!
例如,下面的反应显示了一个大的一级动力学同位素效应,这意味着C-H在速率决定步骤中被破坏。
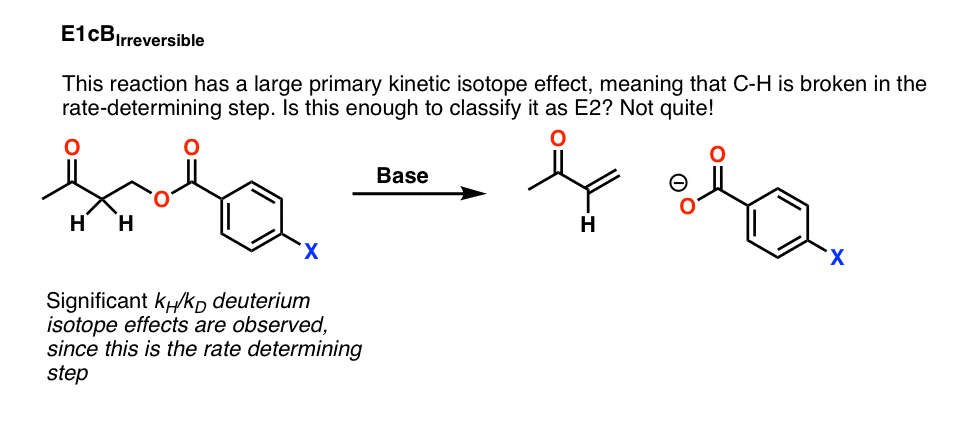
这是否意味着我们可以安全地将这种反应归类为E2?还没有。
有可能这是一个E1cB反应是去质子化共轭碱是慢步,而失之离去基团是快.这叫做E1cB不可逆转的
如果是这样的话,有一个相当简单的方法来测试它:改变离去基团.
打破C-LG键是反应速率决定步骤的一部分E2,但不会是一个决定速率的步骤E1cB.
事实证明,改变离去基团并没有导致反应速率的显著变化。
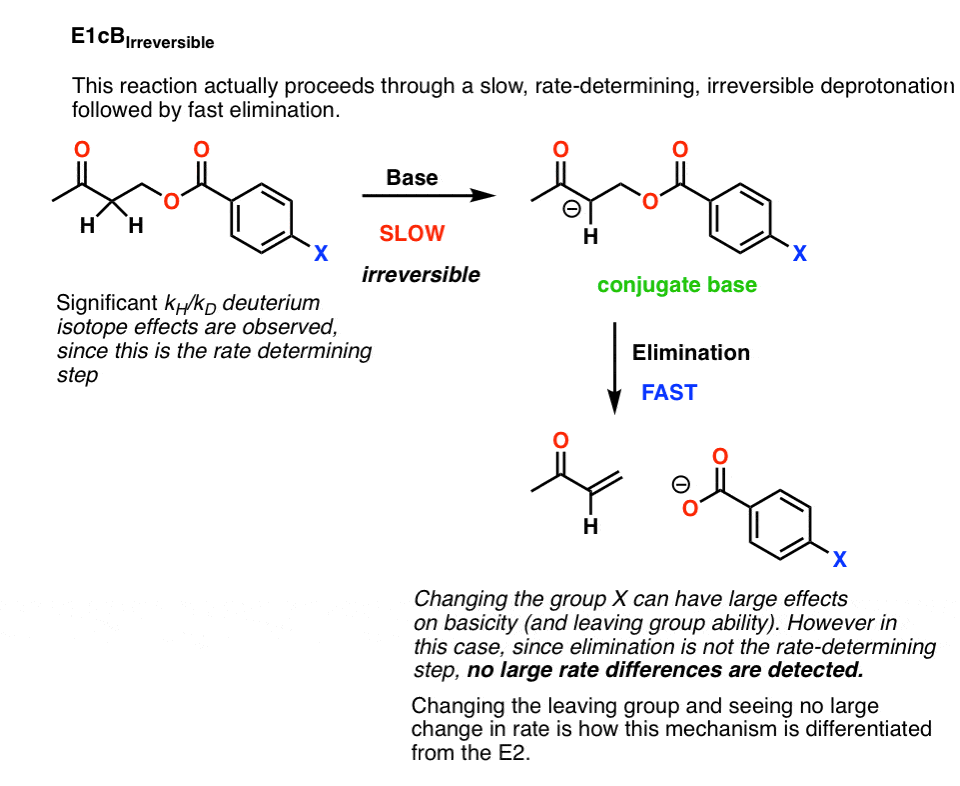
这就排除了E2.
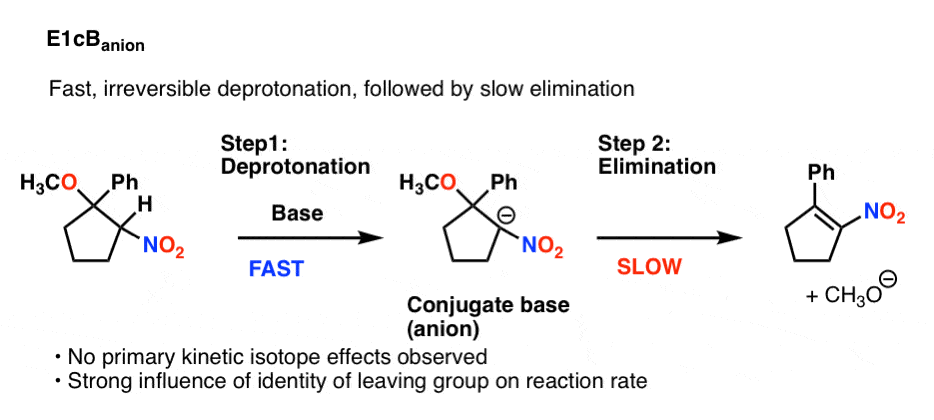
5.E1cbAnion
还有一种主要的可能性,可能是最容易想象的:快速、不可逆的去质子化,然后是缓慢的消除。
这也会不C-H键断裂不属于速率决定步骤,显示出初级同位素效应。反应速率将非常敏感的身份离去基团然而,。
这种味道E1cB叫做E1cB离子。这里有一个例子(看到参考8)
6.总结:三种口味的E1cB
这三个例子说明了三个速率常数的三种可能性:k1(去质子化),它的反质子化(k-1)和消去(k2)。
实验区分了这些不同的“味道”E1cB从E2可以通过研究动力学同位素效应并对其身份进行细微的改变来确定离去基团.
还有一种变体E1cB被称为E1cB离子对,我在这里没有讨论,在这篇参考文献中讨论了。
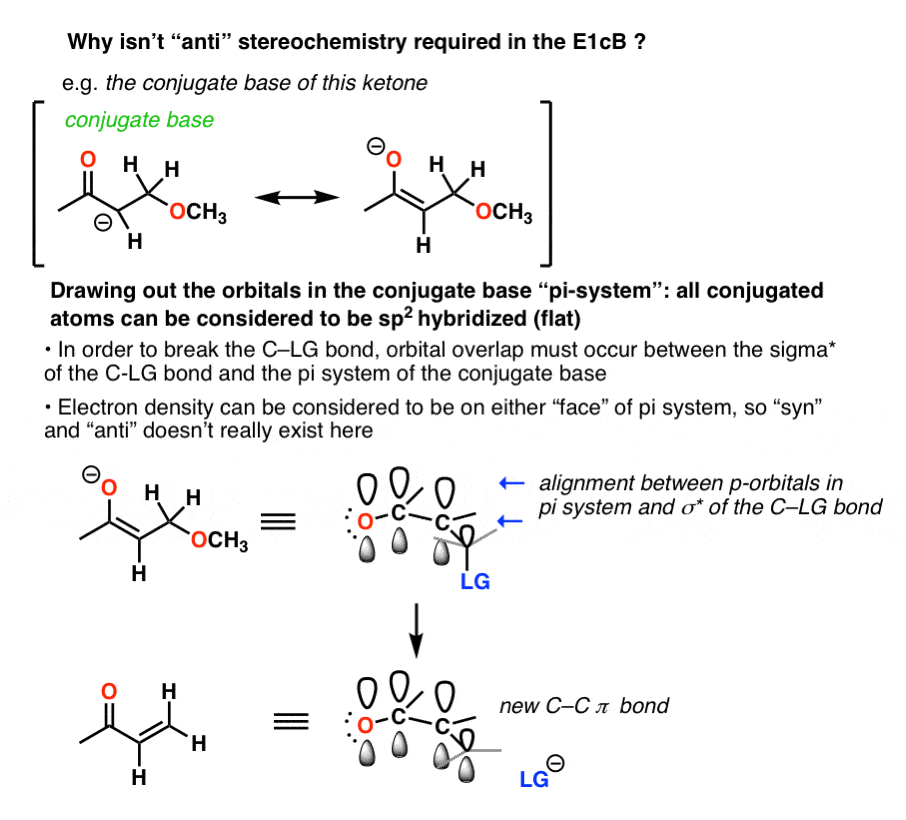
7.立体化学呢?
的E2有严格的立体化学要求碳氢键和碳氢键是相互反的。碳氢键肯定是反使断裂的C-H键的电子对与C-LG的sigma*(反键)轨道对齐。
通俗地说,你需要碳氢键和C-LG键对齐这样它的电子对才能推出的离去基团(同时形成新的PI键)。
没有轨道对齐?没有去质子化。
在E1cB,然而,“syn”和“anti”消除反应都可以发生E1,如果你还记得的话)
的E1cB当C-H键处于合理的酸性时,这种机制起作用。尽管基底可能是四面体(sp3.)开始,一旦共轭碱(阴离子)的形成,一般采用平面(三角平面,sp2)两“面”都有电子密度的结构。的方向离去基团在这一点上,只要C-LG反键轨道与π系对齐,就不重要了。
这是因为C-H键断裂的电子对必须转移到C-X sigma *键的反键轨道上。
在羟醛醇脱水的情况下得到一个阴离子。p轨道上的孤对。p轨道可以被认为在分子的两边都有电子密度,因为两边都有电子密度,所以C-X键无论如何都可以断裂。
(高级)参考资料和进一步阅读
理解“经典”之间的区别E1,E2,E1cB反应很简单。然而,理解这些机制之间的差异是如何决定的,这在核心物理有机化学中是一种冒险。这些是研究生水平的论文!
的一般性讨论E1cB,请参阅现代物理有机化学Anslyn和Dougherty,第10章,还有三月份的高级有机化学.
-
- 的碳原子机制烯烃消除得很深
d·j·麦克伦南
问:化学。Soc。,196721岁,490 - 506
DOI:10.1039 / QR9672100490
的广泛概述E1cB机制有很多例子。 - 9-芴基甲醇在水溶液中的β-消除E1cB机制
R. A. More O 'Ferrall, S. Slae
j .化学。Soc。B。B1970, 260年
DOI:10.1039 / J29700000260
对经典著作的详细的机械研究E1cB9-芴基甲醇中羟基离子的消除反应。 - 之间的关系E2而且E1cBβ-消除机制
R. A. More O 'Ferrall
j .化学。Soc。B。1970, 274年
DOI:10.1039 / J29700000274
关于“更多O 'Ferrall-Jencks图”的第一篇论文,这是一个有用的概念模型,用于检查之间的关系E1,E2,E1cB机制。 - 二卤乙烯的基本消除反应动力学及机理反式消除
西德尼·i·米勒,理查德·m·诺伊斯
j。化学。Soc。1952, 629年
DOI:10.1021 / ja01123a015
在本文中,作者确定的速率常数消除了各种独联体-而且反式-二卤乙烯,发现消除独联体二卤乙烯要快得多。这里的结论是消去独联体-二卤乙烯通过协调过程进行(E2),同时消除反式-二卤乙烯通过阴离子中级(记住:在反式二卤乙烯,H和Cl是syn敬彼此!) - 胺源自二卤丙烯
a·t·波蒂尼,b·j·金和j·m·卢卡斯
j . Org。化学。1962,27, 3688 - 3690
DOI:10.1021 / jo01057a509
另一项研究的作者表明炔烃可以从独联体而且反式烯基陈词滥调。当H和Br反式相互作用(可以用NaOH!),但当Br和H是,需要NaNH2/NH3独联体. 二卤苯与酰胺钾在氨水中反应中卤素的相对迁移率
约瑟夫·f·邦内特和小弗朗西斯·j·基尔利。
有机化学杂志197136(1), 184 - 186
DOI:10.1021 / jo00800a036
本文指出,卤素的性质决定了芳基化合物形成速率的步骤。在Br和I的情况下,去质子化是速率限制的离去基团是F和Cl的速率限制。这些都是E1cB反应。
(据我所知,这篇论文也是独一无二的,因为它是用自由诗写的)消除反应:实验证实了(.beta.-氰乙基)磺离子的预测消除,E2机制
Narinder S. Banait和William P. Jencks
美国化学学会杂志1990112(19), 6950 - 6958
DOI:10.1021 / ja00175a032
研究表明,在消除与良好离去基团,E2即使有强的吸电子基团存在,也会发生。一阶基础启动的。beta.-消去反应包括碳离子中间体
弗雷德里克·g·博德维尔,叶国春和a·c·克尼普
美国化学学会杂志197092(20), 5945 - 5949
DOI:10.1021 / ja00723a022
一个例子E1cB阴离子机制。
- 的碳原子机制烯烃消除得很深
我知道在醛醇缩合中,E1cB机制中的碳离子没有严格的立体化学要求(因为碳离子的电子参与了与邻近羰基的共振),但你能假设碳离子一般是sp2吗?
如果没有相邻的吸电子基碳原子会是sp3吗?这意味着它需要一个反位置来赶走离去基?或者碳离子(比如仲胺/叔胺)不具有手性是因为它们能自发倒转?还是几乎所有的E1cb机制都需要邻近的吸电子基团(如羰基或NO2),这意味着它们都像醛醇反应一样具有sp2性质?
最后,你写道:“注意——显然,当F或Cl是离去基时,去质子化是缓慢的一步。然而,当离去基是Br或I时,脱质子是决定速率的,C-X的断裂很快。”我认为对于F或Cl,你可能会说去质子化是一个“快”(不是慢)的步骤。
谢谢!