有机反应的底漆
7因素稳定负电荷有机化学
最后更新:2022年9月24日|
了解7关键因素稳定负电荷(最终,碱度)
就像我写的以前的文章很好,但是不够——认识到部分费用和找出他们交互。
自反应涉及流程导致的收益或损失的费用,理解稳定的因素(或破坏)负责有一个巨大的影响可能的反应是给发生!
今天让我们来谈谈负电荷,主要是指“负离子”对于我们的目的,但可以广泛引用的孤对电子。
表的内容
- 理解负电荷的稳定性可能帮助我们理解是什么反应(不太可能)发生
- 因素1:高电荷密度是不稳定的
- 因素# 2:元素周期表的随着电负性增加,负电荷的稳定性
- 因素# 3:随着极化率增加了元素周期表,负电荷的稳定性
- 因素# 4:共振稳定的负电荷
- 因素# 5:吸电子集团(电感的影响)稳定负电荷
- 增加提到在原子的杂化实际上是增加其电负性
- 一种特殊情况:芳香性
- 只是另一个词“碱度负电荷的稳定性”
1。理解负电荷的稳定性可能帮助我们理解是什么反应(不太可能)发生
让我们来谈谈一个具体的例子。例如如果一个反应导致形成一个非常不稳定的负电荷,它是不太可能发生。但是如果它导致的损失一个非常不稳定的负电荷,更多的可能。
例如,这就是为什么一个甲烷的反应可能是,另一个是不可能的。这些酸碱反应在这里,顺便说一句。
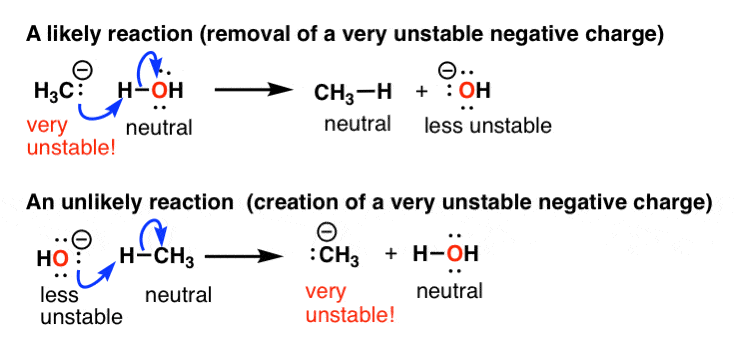
什么因素导致负电荷的稳定?两个主要的事情。
- 负电荷是由相邻的稳定正电荷(相反电荷吸引!)
- 负电荷会更不稳定当它集中和更稳定的当它分散。
想想,你看看这个列表的七个因素,稳定负电荷。
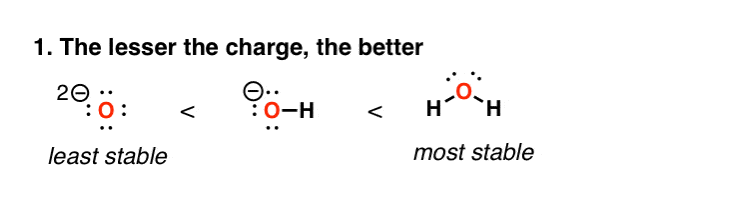
2。因素1:高电荷密度是不稳定的
这个很容易理解。高电荷密度是不稳定的。当我们从水HO (- - - - - -)O (2 -),我们正变得越来越不稳定。这反映在酸性表;水(H2O)更有可能失去一个质子给何鸿燊(- - - - - -比HO) (- - - - - -)是可能会失去一个质子给O (2 -)
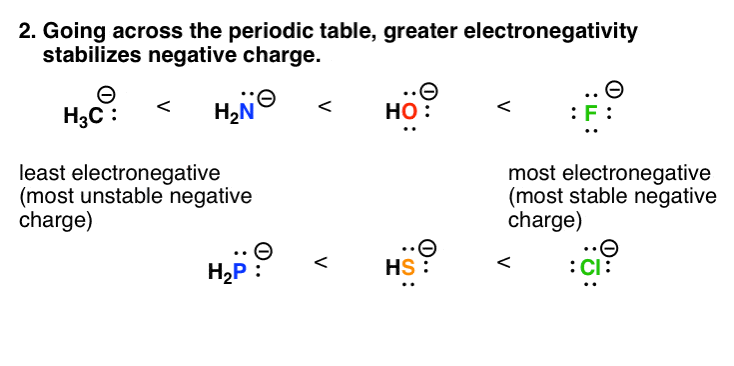
3所示。因素# 2:元素周期表的随着电负性增加,负电荷的稳定性
电负性是一个粗略的测量有效原子的原子核带正电的如何“拉动式”电子向它。(相反电荷吸引。)
电负性增加当我们去在元素周期表。如果你比较阴离子从C, N, O F在元素周期表,负电荷的稳定性将会增加。这也反映在酸度值。
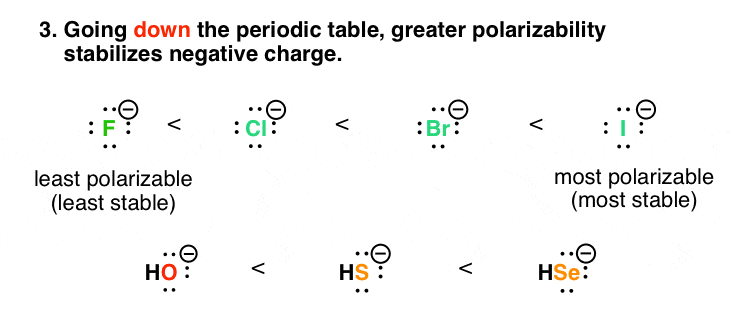
4所示。因素# 3:随着极化率增加了元素周期表,负电荷的稳定性
下来元素周期表,更有助于思考”分散的很好!”而不是“相反电荷吸引”。比较氟和碘。氟离子的大小(半径:119 pm)远小于碘(半径:206点)。然而,他们都有一个负责- 1。
想象两个球,每个重一磅。但一个是铁做的,另一个是用橡胶做的。这球是小?小铁球(和困难-更稠密)就像氟,和橡皮球(大和缩)就像碘。和“*有助于稳定,因为它没有集中在一个体积小。这是一个更大的表达方式极化率碘。
低电荷密度更稳定!
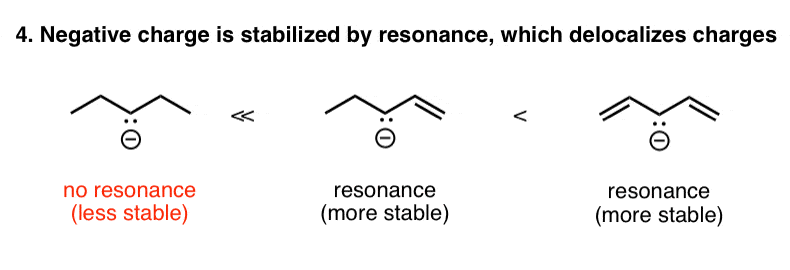
5。因素# 4:共振稳定的负电荷
同理,一个负电荷,相邻的一个或多个π(π)债券可以驱散的负电荷多个原子。我们描述这一现象为“共振”。
在下面的例子中,左边的带负电荷的烷烃比相邻的带负电荷的物种更不稳定,在负电荷可以分散在多个碳通过共振。这是另一个例子是如何减少电荷密度(或传播)稳定的影响力。
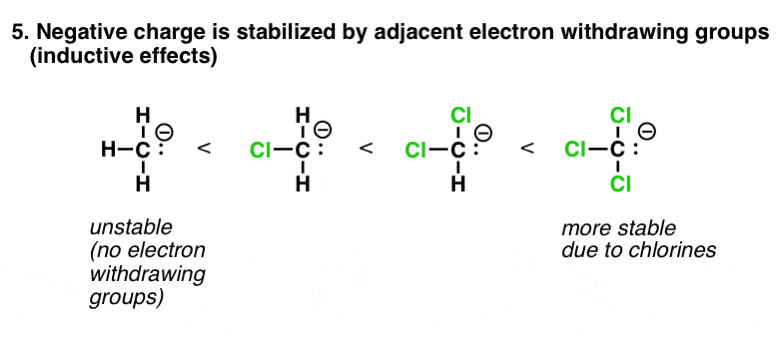
6。因素# 5:吸电子集团(电感的影响)稳定负电荷
这个下降更多的支持下“相反电荷吸引”。这是一个负电荷相邻一个原子与电子撤回组这将是多更稳定的这不是比同等原子。CCl的极端的例子3(-),由此产生的离子比H许多数量级更稳定3C(-)本身。(这是卤仿反应的基础上,顺便说一下-看到帖子)。
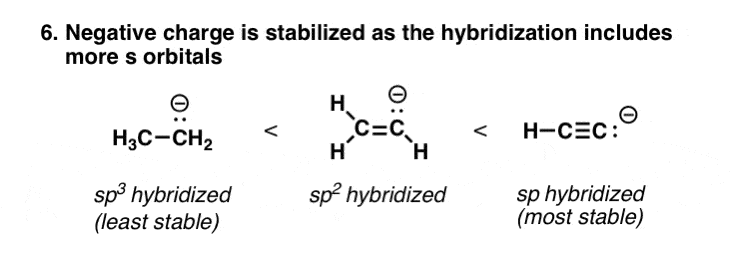
7所示。增加提到原子的杂化相当于增加电负性
s轨道是接近原子核比p轨道。所以在s轨道电子会比电子接近原子核在p轨道,因此,低能量(“相反电荷吸引”)。由于这个原因,在sp电子轨道能量低于sp2,这是能量低于sp3,因为他们有更大的年代字符(sp为33%2比sp)3(25%)。这使得阴离子更稳定,就好像它是在一个更原子的电负性。
这就是为什么终端炔烃(pK一个= 25)更酸性比烯烃和烷烃(pK一个= 50)
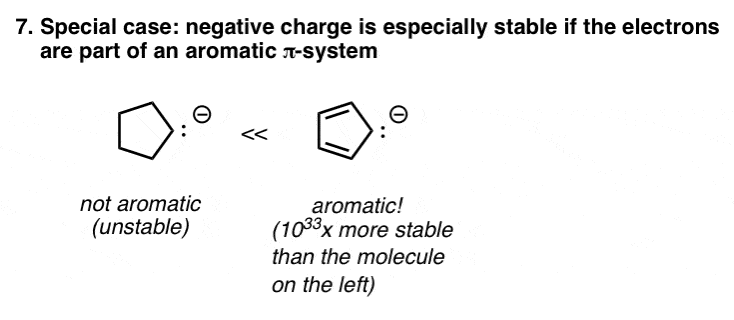
8。一种特殊情况:芳香性
这是一个特例,详细介绍有机化学2 (看前面)。某些分子——拥有一个特别稳定芳香性——这是非常稳定的,有点像从政府巨大的税收减免资格。
某些带负电荷的分子,如环戊二烯基阴离子,如下图所示)芳香,因此具有更大的稳定性比其他。
9。只是另一个词“碱度负电荷的稳定性”
七个因素? ! ! !那么,我们如何知道哪些是最重要的?
这是个很好的问题!这些趋势可以在不可预知的方式相互作用,很难判断哪些是最重要的。
值得庆幸的是,有一个概念你可能已经见过弄清楚这些物种的稳定性,很容易测量。它被称为碱度。这些因素决定稳定的基础如何!
一个物种的碱度告诉你如何稳定的孤对电子。
我们如何找到一个好的碱度的测量?简单。它在pK一个表相比,测量数据的集合,在扑克桌上的优势。
底线:
- 注意两个因素:相反电荷吸引和分散。
- 不稳定的离子会在开始的尾巴箭头(债券)形式。
- 稳定的离子会在最后一头箭(可能离开组)
谢谢你的分类,但将阴离子乙炔比苄基的阴离子更稳定?
(我的意思是,例交叉相互电负性与共振。
共振发生在碳sp2配置(苄基的阴离子)的情况下,
所以,我更稳定吗?
甲苯的pKa大约是42。乙炔的pKa大约是25。所以阴离子对乙炔的共轭碱比的阴离子更稳定的甲苯的共轭碱。
更分散的意味着什么?
这意味着它不集中;分散到更大的体积。
三苯基甲基负碳离子和二苯基甲基负碳离子稳定的原因
根据埃文斯Pka表,http://evans.rc.fas.harvard.edu/pdf/evans_pKa_table.pdf、三苯甲烷的pKa 31和二苯基甲烷的pKa 33。有大约100倍增加三苯甲烷共轭碱的稳定性。你认为是为什么?
你好詹姆斯,
我想谢谢你这个太棒了你的项目,我真的希望教师重视直觉和适当的教学做而不是显示机制。
我难以理解的概念,很高兴听到你思考:
1。你写道,高电荷密度是不稳定的,之后通过编写,原子的电负性更稳定,这在我看来是矛盾的。不是一个电负性原子/离子一定创建一个高电荷密度区域由于其强大的电子的吸引力?
2。后你的推理sp比sp3轨道比sp2更稳定,因为他们有更多的s轨道,因此接近原子核和更低的能源,但我们也得到更多的π键(更高能量)等分子杂交过程更少,而更多的杂化分子π键将至少有一些字符,会降低他们的能量。这些推理不是矛盾的吗?
谢谢你的时间!
1。“高电荷密度不稳定”是一个很好的经验法则,虽然它不是容易的看看这个定量,因为一些变量是不同的。它更直观的原则。例如,比较水的稳定性与何鸿燊(-)和O(2 -),或NH3和氨基(-)与NH(2 -)和N (3 -)。
鉴于此,如果一个人有一个负电荷,负电荷将稳定* *的更多元素的电负性。这一趋势最明显的是在元素周期表中——例如F(-)与何鸿燊(-)与氨基(-)和甲基(-)。氟原子的电负性是最元素在本系列和F(-)也是最稳定;碳是最负电性元素和甲基(-)是最不稳定的。
沿着周期表并不简单,因为价电子在轨道离原子核更远和极化率是更重要的。
2。π键没有任何字符。π键是完全重叠的p轨道。为了确保这是明确的,如乙烯分子中两个碳双键相连,这些债券中只有一个是一个π键,另一个是σ键两sp2杂化碳原子。
对不起,我的意思是sp (n)杂化轨道(而不是π)说,CN -和CH3 CN -有一个低能量sp轨道和两个高能p轨道和CH3——这两者之间有三个杂化轨道,聪明(能量)。
电荷是本地化的sp (n)轨道的p轨道CN(-)无关的稳定。
看它的一种方式是,一个sp轨道有效电负性高于sp2,高效的电负性比sp3轨道。负电荷和核的关系更加紧密。
谢谢你,我想我开始懂了。这是类似于电负性,因为在这两种情况下(更高的sp字符/电负性)债券接近原子核。
会说的正确,p轨道之间的移位原子CN(-)也在稳定中起着部分负电荷吗?
编辑:注意到碳上的孤对本地化所以不能稳定通过移位没关系,最后一个问题:)。
再次感谢。
你好,
请帮助选项。学校的项目——有机玻璃负从砂中提取聚苯乙烯。我们使用有机玻璃表并与羊毛辊摩擦负载有机玻璃负面,但电荷不断波动,并不解除聚苯乙烯。建议如何增加负电荷强?
在确定periority负碳离子的稳定性:共振或轨道
这可能是一个愚蠢的问题,但我有点困惑为什么氟原子的电负性是最、最稳定在图2中,但是在图3中氟至少可极化的和最不稳定?你怎么知道什么时候考虑它的电负性或可极化的吗?
很难知道从第一原理是否电负性或极化率是最重要的在确定离子的稳定性。酸度的测定,然而,已经给我们的能力来评估这一普遍规模(酸性)。我们可以观察到实证的趋势(电负性是最重要的是当我们穿过一排周期趋势,极化率是最重要的是当我们沿着),但解释为什么这是深,难回答的问题。
这只取决于反应?一个问题,量子力学有任何关系吗?因为如果它生病停止问问题!
谢谢你把这个!这个网站非常有帮助。
一个更正:6。轨道,你状态,sp2 50% s轨道。我相信sp已经50%,但sp2实际上有33.333%。如果我错了请让我知道!
再次感谢你的时间投入这个东西!
哦不错——谢谢你的校正!
是一种共振稳定的化合物比两倍或三倍保税化合物稳定吗?
不可能回答这个问题没有一个更具体的例子。
对于乙烯和苯乙炔和苯