Dienes和MO理论
Cope和Claisen重排
最后更新:2023年2月14日
Diels-Alder的近亲:Cope重排和Claisen重排
- Cope重排和Claisen重排是与Diels-Alder反应属于同一家族的周环反应,它们经历了一个循环的6电子协同跃迁态,并遵循轨道对称规则。
- 在这篇针对有机化学入门课程学生的文章中,我们将通过例子、机理和应用介绍这两种反应。
目录
- Cope重排:实例与机理
- Cope重排是一种均衡
- 应对环劳损
- Oxy-Cope重排
- 克莱森重组案
- 烯丙基苯醚重排
- 氨基酸生物合成中的Claisen重排
- 摘要:Cope和Claisen重排
- 笔记
- 测试你自己!
- (高级)轨道对称性在Cope和Claisen
- 大planone B的高级合成
- (高级)参考资料和进一步阅读
1.Cope重排:实例与机理
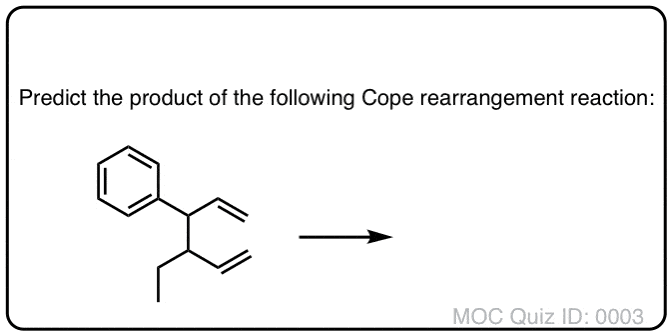
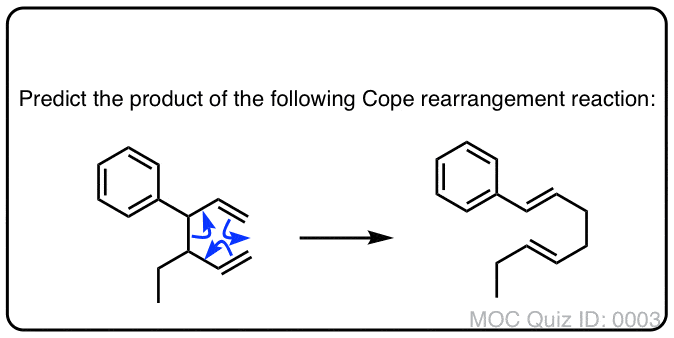
下面的反应叫做应对重排.在这个反应中,将1,5-二烯加热到150°C(或更高),这时起始原料产生重排产物。
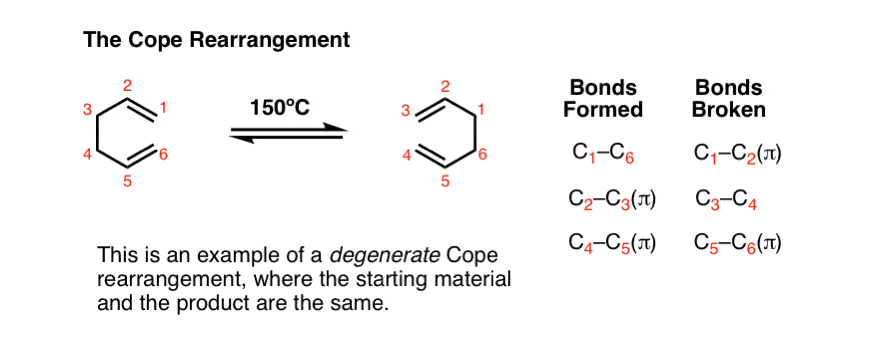
Ta-daa ! !
上面的例子是可能的最简单的例子(“退化”Cope重排),它只是重新排列成它自己。
如果你通过这一个反应来判断Cope的重排(就像我曾经那样)你得出这样的结论也是情有可原的变态的无用的.相信我,它不是。[请注意]
让我们来看看这里形成和断开的键:
- 形成两个C-C π键(加上一个C-C sigma键)
- 两个C-C π键断裂(加上一个C-C sigma键)。
那么它是如何工作的呢?
和Diels-Alder反应一样,Cope重排反应属于一个被称为“化学反应”的大家族。pericyclic”反应。Cope重排通过一个协调的,循环的过渡状态,没有带电的中间体。
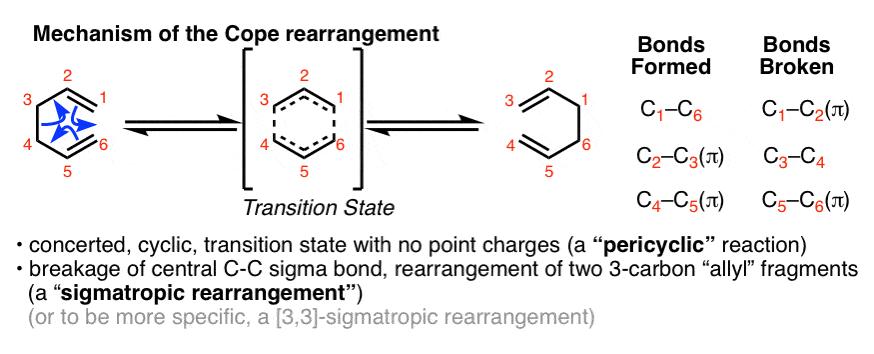
Cope重排也是“sigmatropic”重排的一个例子,其中sigma键(及其取代基)在共轭pi系统上交换端点[注1]
2.Cope重排产物与起始物质处于平衡状态
Cope重排的产物也将是1,5-二烯,因此能够进行反向反应。
因此,产品分布将反映平衡在起始物质和重新排列的产物之间。
在简并的Cope重排(上图)中,不可能看到是否发生了什么,因为起始物质与产物是相同的。[注2-有一种方法可以绕过这个问题,使用同位素“标记”碳]
那么平衡是如何倾斜的呢,有用的?
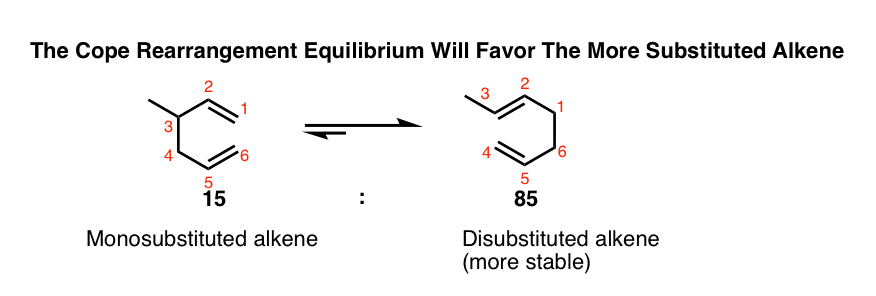
还记得扎伊采夫规则?(即“更多的替代烯烃赢了”)。烯烃稳定性略有增加(例如约1-2千卡/摩尔),连续的C-H键在烯烃被碳碳键取代。
1-2千卡/摩尔可能听起来不多,但足以让反应顺利进行!
在下面这个简单的例子中,只要在C-3上放置一个甲基,就会得到一个有二取代基的重排产物烯烃而不是一个取代基烯烃.结果是85:15的产品混合物(5:1)。[注3]
阿瑟·c·柯普和伊丽莎白·哈代在1940年提出的这个例子,有一个三代烯烃重新排列成四取代基烯烃这也是和an的共轭酯和一个腈.这是作为单一产物获得的。[注意4]
3.应对环劳损
一个Cope重排,真正将它的触角伸向了一个单一产物的形成,它有一个C-C sigma键,它是一个张力环系统的一部分。这种对“独联体-divinylcyclopropane”发生低于室温.[注5]
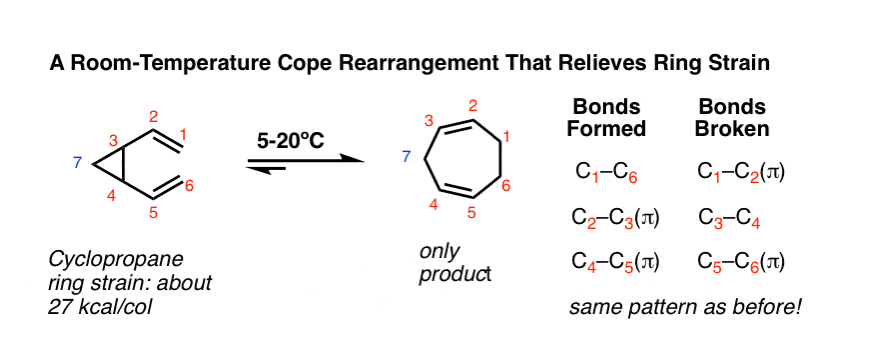
仔细看!尽管反应的外观有些奇怪,但化学键的形成和断裂模式是相同的!
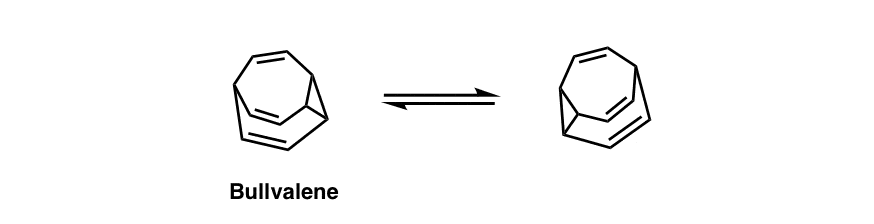
化学家们将这种由张力驱动的Cope重排发挥到了更加疯狂的极端。不是的。”牛”有一种分子没有固定的结构,因为它在不断地应对自己。[注6]
4.Oxy-Cope重排
在上面的例子中,我们看到即使在C-3上有一个不起眼的甲基,也足以得到有用的5:1比例的Cope重排产物。
沿着这些路线,已故的伟大的杰罗姆·伯森教授(和他的博士后梅特兰·琼斯教授,纽约大学和教科书的声誉)在1964年报告说,3-羟基取代1,5-二烯的Cope重排导致了一个烯醇产品。
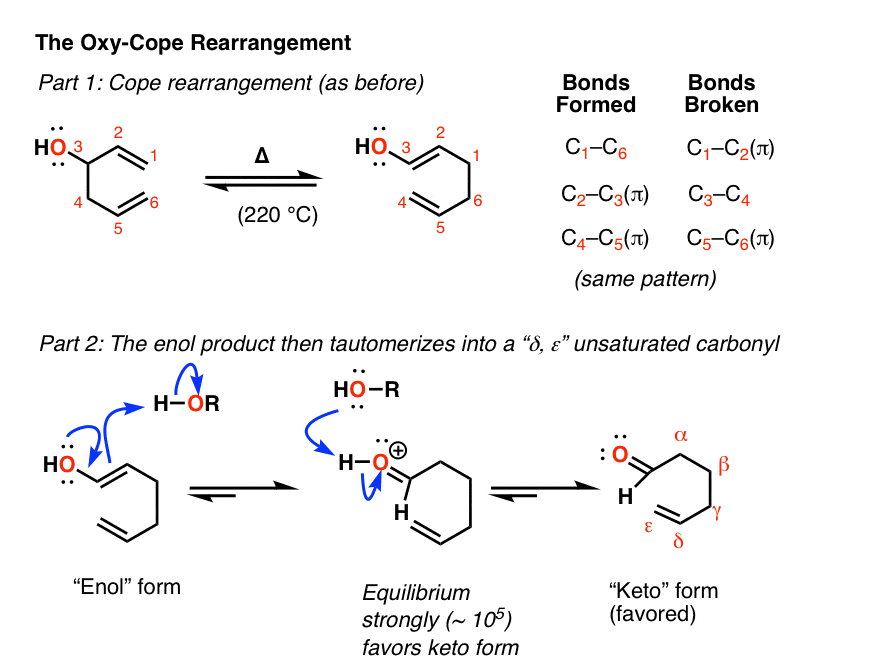
如果你回想一下,回想一下炔的硼氢化和氧汞化反应,你可能记得烯醇往往不会停留很长时间。
通过一个叫做酮的过程烯醇互变现象,烯醇经历了一次重新安排酮(或醛(取决于起始物质的结构),从而不可逆地形成我们所说的“gamma, delta”不饱和物质醛或酮.(看到帖子:Keto-Enol互变现象)
酮烯醇互变异构是一种平衡,由于C-O键的强度大于C-C键的强度,通常倾向于酮态。[请注意7]。在至少一种情况下,平衡被测量为10左右5喜欢生酮]
像Cope Rearrangement一样,Oxy-Cope仍然需要大量的加热。(Berson-Jones的一个例子是在密封管中加热至320°。)[注8如何让这一切变得更快]
5.克莱森重排
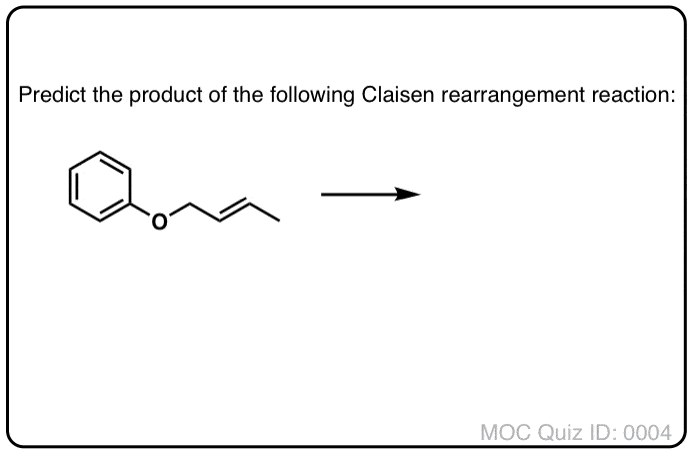
与Cope重排相似的是一种稍早的过程(1912年),被称为克莱森重排.(是的,这是一样的路德维希·克莱森导致了Claisen凝结)。这也是一个周环反应。
在克莱森重排中,a乙烯基烯丙基醚加热得到γ,δ (γ,δ)不饱和羰基.
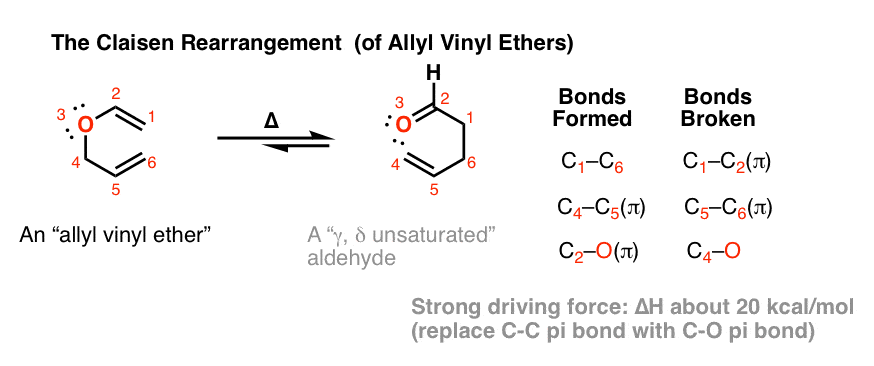
- 形成了C-C sigma键,C-C和C-O键。
- 两个C-C π键断裂(还有一个C-O sigma键)。
如果我们比较断开键的能量和形成键的能量,我们会发现碳碳键相对较弱(约65千卡/摩尔),而碳氧键相对较强(约85千卡/摩尔)。增益约为20千卡/摩尔.
(C-C sigma键和C-O sigma键的键解离能大致相同(大约85千卡/摩尔)所以它们基本上抵消了)
一个反应的产物大约20千卡/摩尔(~85千焦/摩尔)比反应物更稳定不可逆转的。这只是克莱森重排如此有价值的一个特征。注意9]
那么它是如何工作的呢?从箭头推动的角度来看,它看起来很像Cope重排!
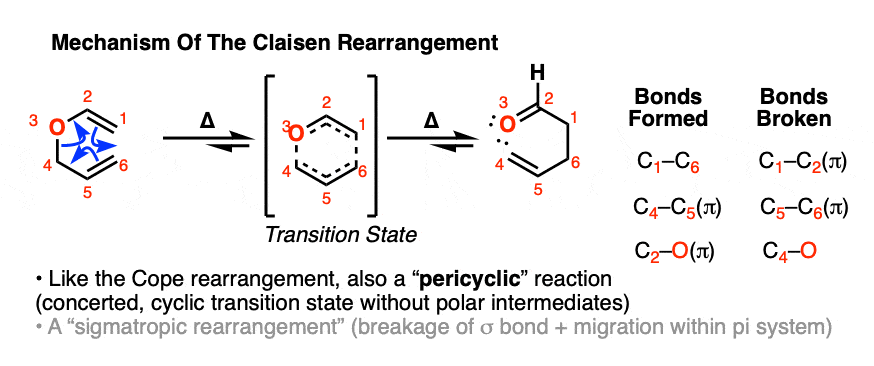
我们在这里不讨论克劳森重排的立体化学,但可以说它通常遵循一个非常可靠的模式,使它成为立体选择性合成的主力。[注意10]
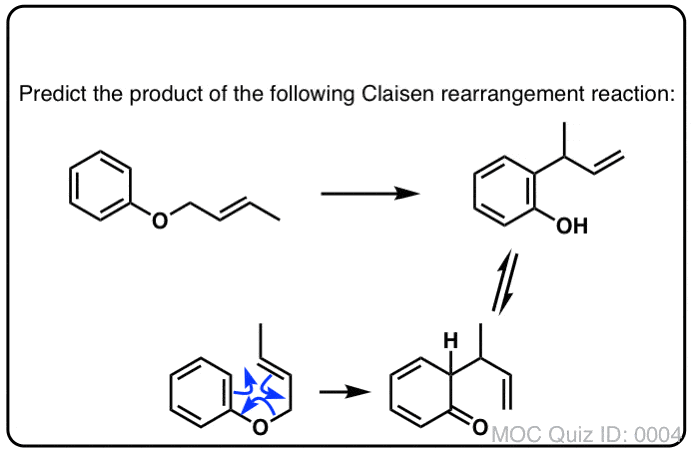
6.烯丙基苯醚重排
芳香族系也可参与克莱森重排。加热烯丙基苯基醚[注意11]导致克莱森重排,导致γ, δ不饱和内酯.
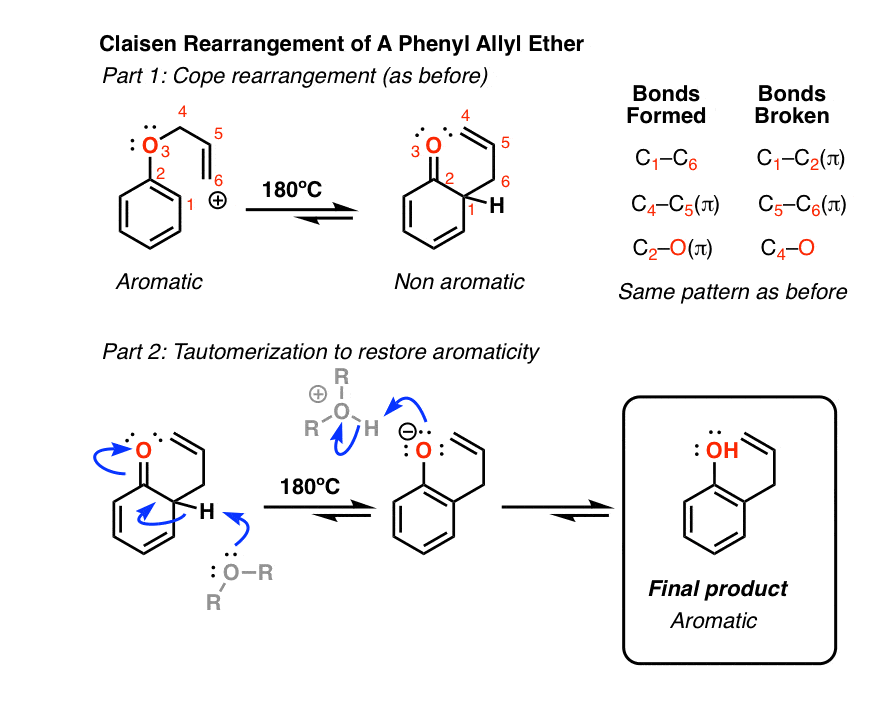
尽管克莱森重排在那里停止,第二个反应立即发生(不能停止)。
如果你讲了芳香性,你就会发现克莱森重排的产物不再是芳香;sp的3.4 sigma键上的碳阻止了环上的共轭。
碰巧,这是酮的另一个机会烯醇互变异构使其抬头,尽管这一次驱动力朝着相反的方向(从酮到烯醇)!原因是芳香性所赋予的稳定性(共振能量>30千卡/摩尔),足以弥补较小的能量差异(请注意7)烯醇形式。
如果昊图公司位置被堵住了?看看你是否能弄清楚这个有趣的机制。
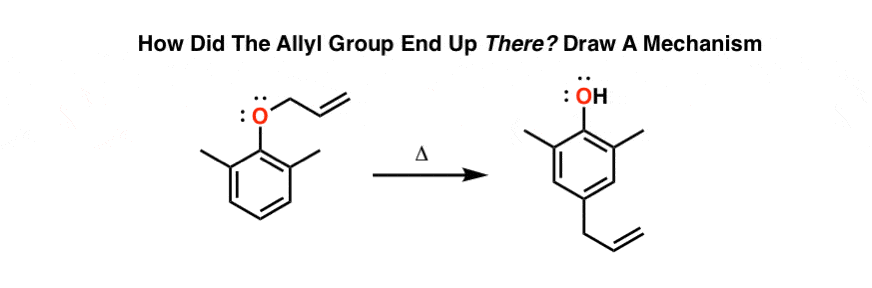
7.自然界中的克莱森重排
事实证明,克莱森重排发生在活的生物体中。正如你所料,大自然发现了一种用酶催化反应的方法,而不是忍受150°C的高温。
下面是拟序物的重排图。这个反应是由chorismate mutase酶催化的,它导致一个速率加速度约为106.注意键的形成和断裂的模式——尽管这些分子的外观有些怪异,但在上面的反应中发现了完全相同的键的断裂和成键的模式。
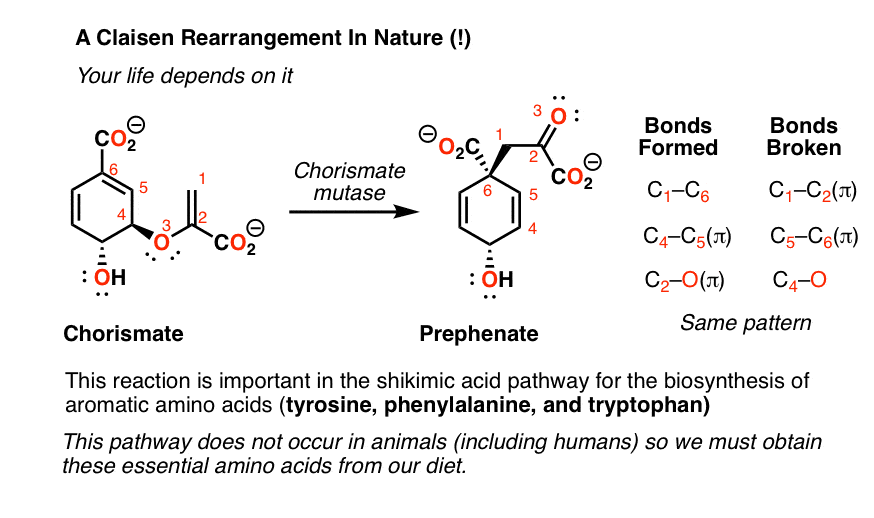
为什么这种生物合成途径很重要?这是关键的一步莽草酸途径负责人体必需氨基酸色氨酸、苯丙氨酸和酪氨酸的生物合成。这种途径在动物(包括人类)中不起作用——这就是为什么我们必须从饮食中获取这些氨基酸。
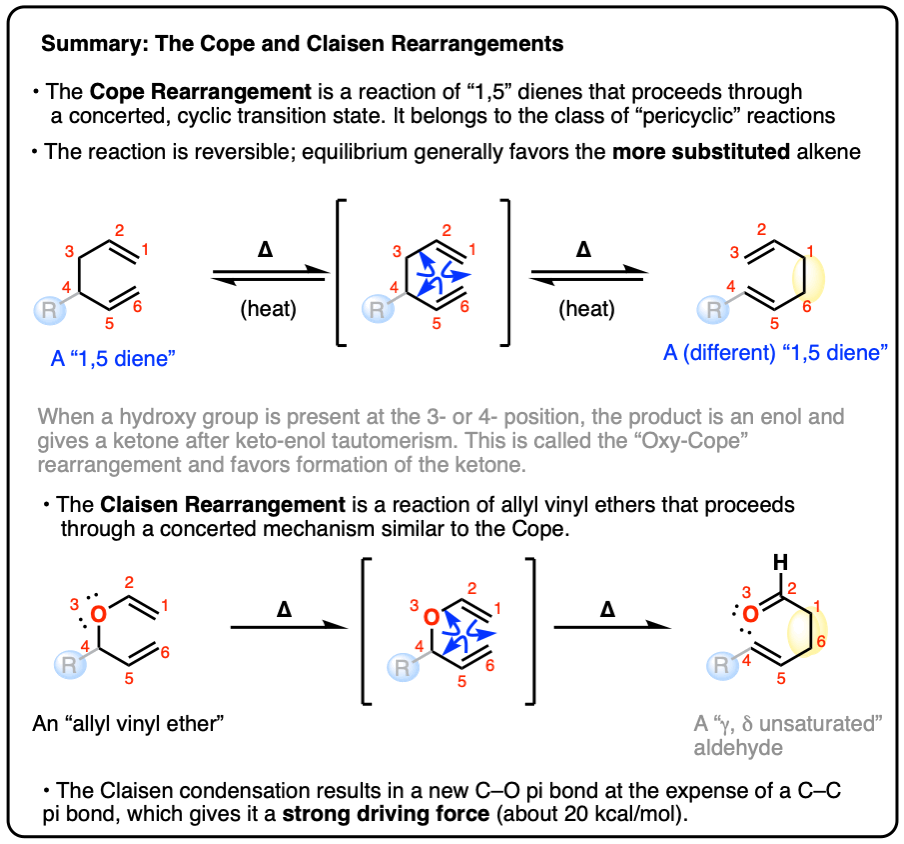
8.摘要:Cope和Claisen重排
在这里,我们仅仅是略微改变了Cope和Claisen重排的表面,但对于大多数入门课程的学生来说,这就足够了。
- 像所有的周环反应一样,Cope和Claisen重排也受到雷竞技下载最新版Woodward-Hoffman规则关于轨道对称性。轨道对称性的Cope和Claisen重排可能超出了大多数入门课程的材料,但在处理附录下面
- 同样立体化学的细节,包括过渡态的椅形(有时是船形!)几何在这里被忽略了。想要享受一段美好时光,可以看看经典的电影Doering-Roth实验.梅特兰·琼斯也在他的书中讨论了这些问题教科书.
- Cope和Claisen在合成中的应用不胜枚举。克莱森重排有超过15种变体,其中一些是最近才开发出来的。有机化学是一门活跃的学科,新发现不断发表!
笔记
的活化能大约33千卡每摩尔的活化能克莱森重排的热量约为30千卡/摩尔。[参考文献]
注1。IUPAC定义了一个单键转移的重排,这是一种周环反应,涉及到π和σ键的总数不变的新σ键的断裂和形成。
注2。人们可以观察到“简并”的Cope重排13C核磁共振,如果有人安装一个13其中一个端子上有C标签烯烃1,5-二烯(图中为C-1)的原子。Cope的平衡位置可以通过观察a的外观来监测13C标记亚甲基(CH2)组。
注3。利用吉布斯自由能关系(Δ G = -RT ln K),在150°C时85:15的比例对应的能量差约为1.5 kcal/mol。它不需要太多的能量差来推动平衡朝着一个有用的比率!
注4。最初的报告关于Arthur C. Cope和Elizabeth Hardy的Cope重排:
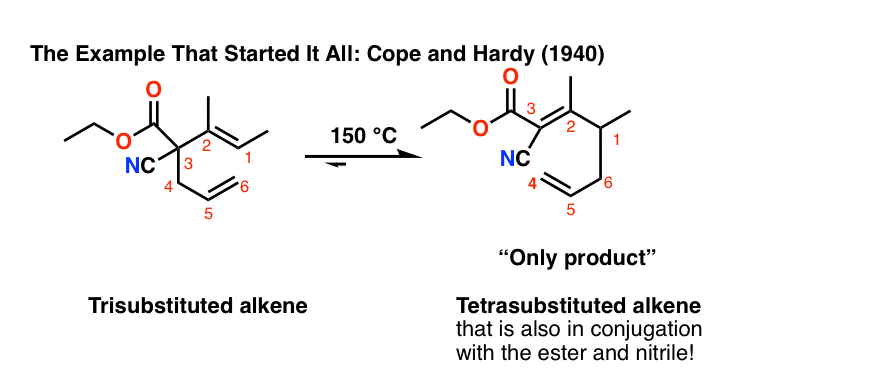
注5。只有独联体-二乙烯基环丙烷容易重排。的反式-二乙烯基环丙烷必须加热到约190°C才能重新排列,因为环丙烷首先需要破碎。[Jacs 1972 94 5910]
注6。Bullvalene(下图)是一个没有固定结构的分子。它的生命是一系列永无止境的Cope重排;所有碳原子的化学位移都是相等的。
注7。迈威尔公司测得平衡常数约为105根据吉布斯方程,能量差约为7千卡/摩尔。
注8。这似乎阻碍了该反应的应用,但大约10年后Evans和Golob发现用氢化钾处理起始物质会使Oxy-Cope重排进入超加速状态,大大降低了激活障碍(约10-15千卡/摩尔),以至于反应可以在室温或更低的温度下发生。这就是现在所说的阴离子Oxy-Cope重排”。有关Oxy-Cope导致蟑螂性信息素periplanone B合成的有趣示例,请参阅附录.
注意9。从合成的角度来看,克莱森重排之所以有用的一个微妙特征是,它以一种非常可预测的方式,用一个相对容易合成的键(C-O)交换了一个相对难以合成的键(C-C)。(例如,我们已经学过几种形成碳氧键的方法威廉姆森醚合成,添加酒精到烯烃而且炔烃,以及其他各种程序。)
注意10。关于克莱森重排的一个令人着迷的细节是立体化学信息的传递。如果C-O键和双键以立体选择的方式(E或Z)构造,那么这种几何结构可以传递到具有非常可预测的立体化学的新手性中心的形成中。这已经被很好地开发用于爱尔兰酯烯酸克拉森重排.
注意11。很容易从威廉姆森制成醚合成,对吧?
测试你自己!
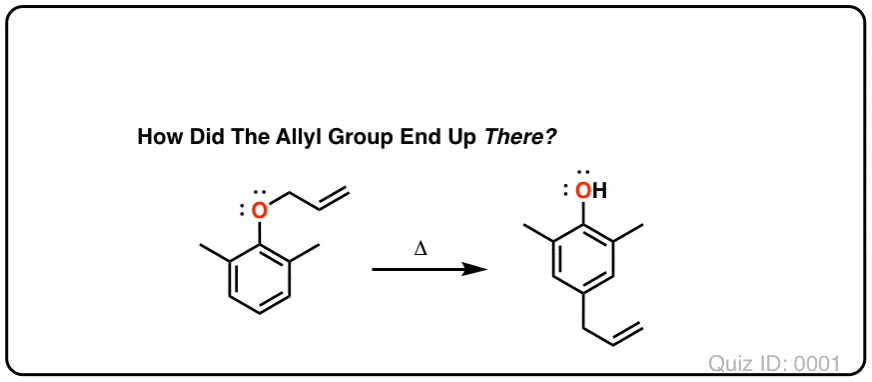 点击翻转
点击翻转

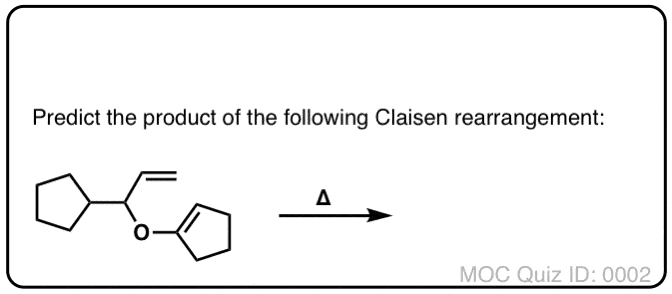 点击翻转
点击翻转
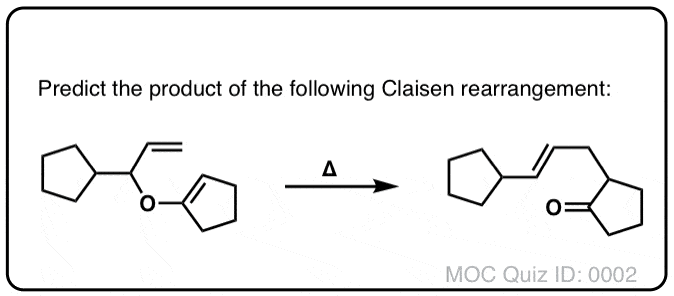
 点击翻转
点击翻转
 点击翻转
点击翻转
(高级)Cope和Claisen重排中的轨道对称
作为周环反应,因此是Diels-Alder反应的亲戚,你会发现轨道对称性必须出现在某个地方,让我们能够合理地解释为什么Cope和Claisen重排是“热允许的”。
得出这些反应的轨道最简单的方法是把它们想象成两个烯丙基片段结合在一起。如果我们回想一下烯丙基的HOMO我们讲过在这里) HOMO是分子轨道,其末端叶相相反,中心是一个奇怪的点(这是因为一个节点穿过了中心碳)。
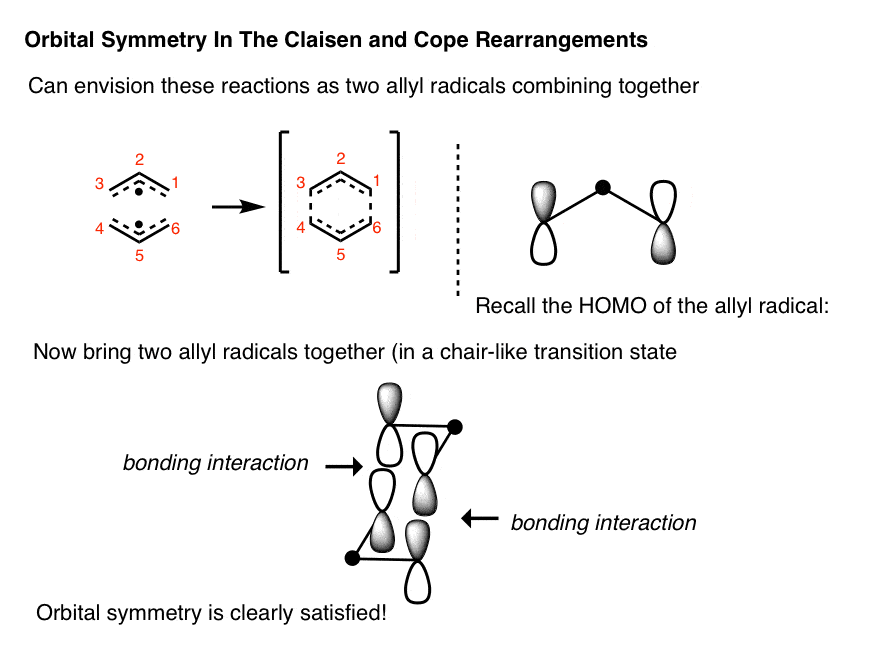
如果你这样结合两个烯丙基轨道会很好地排列。我们没有详细讨论Cope过渡态的几何结构,但它倾向于像椅子一样的物质,这就是为什么我们这样画它。
我们把事情做得很简单。Cope的机制仍在探索中,有一些途径表明过渡态确实类似于两个烯丙基的结合!
Oxy Cope在蟑螂性信息素合成中的高级应用
如上所述,哈佛大学的David Evans和他的合作者A. Golob在1975年报告了oxy-Cope重排显著如果羟基被去质子化,反应会加速醇盐离子与产生的反离子的配位弱。这导致了许多令人兴奋的天然产品合成冒险.
一个相当简单的方法是添加乙烯基格氏试剂变成不饱和的酮,然后用温和的加热。在下面的例子中,60°C就足够了!
Stuart L. Schreiber教授(当时在耶鲁大学,现在是哈佛大学)和研究生Conrad Santini对蟑螂信息素periplanone B的合成是伍德沃德-霍夫曼规则的大师课程。
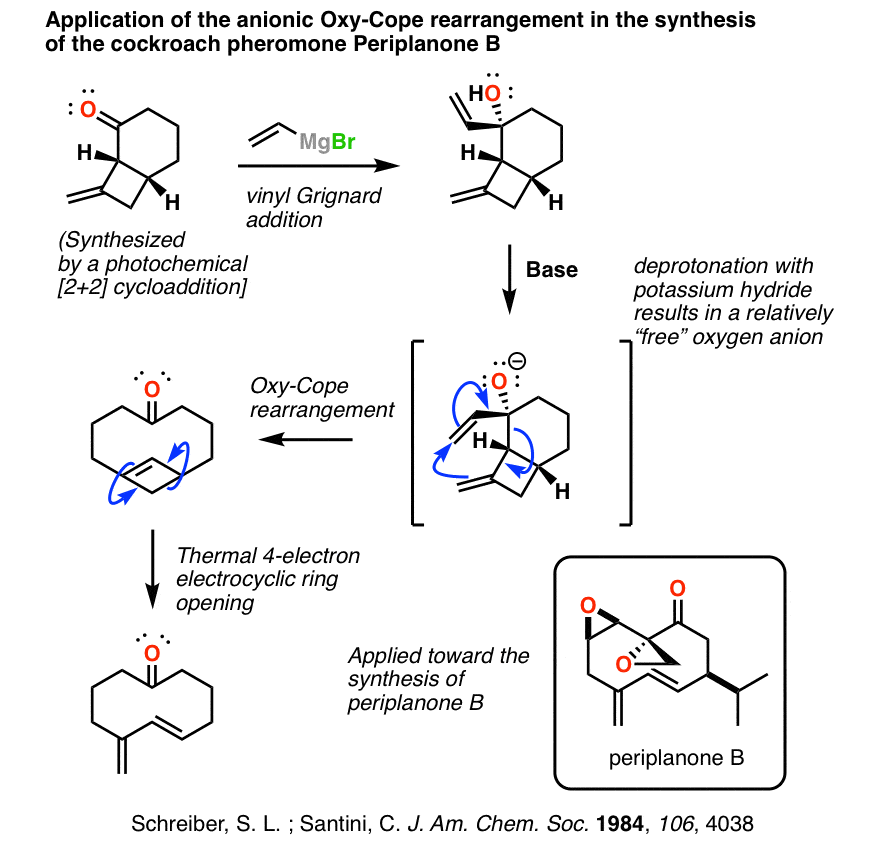
它从光化学[2+2]环加成开始,形成双环体系。添加一个乙烯基格力纳德建立了阴离子Oxy-Cope[3,3]柱状重排,产生高度紧张的环丁烯。然后经过热电循环环打开,产生二烯,二烯随后环氧化为蟑螂信息素。
现在是有趣的部分。
在合成了信息素之后,Schreiber和Santini开始在耶鲁化学大楼的地下室寻找蟑螂:

那一定是一种怎样的感觉。
参考文献很多,因为这两种反应都非常有趣和有用。
- 取代的介绍乙烯基组。五、三碳体系中烯丙基迁移的重排
Arthur C. Cope和Elizabeth M. Hardy
美国化学学会杂志1940年,62(2), 441 - 444
DOI:10.1021 / ja01859a055
关于这一反应的最初报告后来被称为Cope重排。Cope重排及其变体(例如oxy-Cope和阴离子oxy-Cope重排)是[3,3]- sigropic重排。这是一个协调一致的反应这是一个平衡过程。这是以Arthur Clay Cope教授命名的,他是麻省理工学院的教授。美国化学学会以他的名字命名了阿瑟·柯普和柯普学者奖。 - 在Cope重排中两个烯丙基的重叠或四个中心的过渡态
w·冯·e·多林,w·R·罗斯
四面体,1962年,18, 67 - 74
DOI:10.1016 / 0040 - 4020 (62) 80025 - 8
在这一经典研究中,von Doering和Roth基于非对映体前体的重排,提出了Cope重排的六元环椅式过渡态。以下论文是关于Oxy-Cope重排的。这种变体提供了一个热力学汇,因为重排导致了一个烯醇的互变异构酮/醛,提供热力学驱动力。 - 3-羟基-1,5-己二烯热异构合成酮的研究。Oxy-Cope重排
杰罗姆·a·伯森和梅特兰·琼斯
美国化学学会杂志1964年,86(22), 5019 - 5020
DOI:10.1021 / ja01076a067
这是第一篇描述重排的论文,也是作者在这里提出的术语“Oxy-Cope”的起源。 - 氧- cope重排中的逐步机制
Jerome A. Berson和Maitland。琼斯
美国化学学会杂志1964年,86(22), 5017 - 5018
DOI:10.1021 / ja01076a066
Oxy-Cope的一个变种是阴离子Oxy-Cope重排,它使用一个基生成一个醇盐,生成烯醇化物与传统的Cope或Oxy-Cope反应相比,允许显着降低温度。 - [3,3] 1,5-二烯醇氧化物的星形重排。强大的加速效果醇盐取代基
d·a·埃文斯和a·m·戈洛布
美国化学学会杂志1975年,97(16), 4765 - 4766
DOI:10.1021 / ja00849a054
第一次出版阴离子Oxy-Cope重排。开创性的。 - 宏展开方法:基于八单元环展开过程的中环合成
保罗·a·文德,斯科特·麦克恩。西伯思,约瑟夫·j·佩特里蒂斯,苏尼尔·k·辛格
四面体1981,37(23), 3967 - 3975
DOI:10.1016 / s0040 - 4020 (01) 93271 - 5
应用阴离子大环合成中的Oxy-Cope重排,来自Paul A. Wender教授(现就职于斯坦福大学)的实验室。 - Über Umlagerung von Phenol‐allyläthern在C‐烯丙基‐phenole
l·克莱森
化学。的误码率。1912,45(3), 3157 - 3166
DOI:10.1002 / cber.19120450348
烯丙基[3,3]热重排的首次报道苯基醚,后来被命名为克莱森重排路德维希·克莱森发现后 - 重排乙烯基烯丙基醚
查尔斯·赫德和麦克斯韦·波拉克美国化学学会杂志 1938 60(8), 1905 - 1911
DOI:10.1021 / ja01275a051
利用热化学测量,烯丙基的重排乙烯基 醚在本研究中,烯丙基乙醛的含量约为24千卡/摩尔(100.6 kJ/mol)。 - 克莱森重排的机制:Déjà Vu All Over Again
布鲁斯Ganem
Angew。化学。Int。艾德。1996年,35(9), 936 - 945
DOI:10.1021 / anie.199609361
综述了Claisen重排的机理,包括溶剂效应、催化效应、立体电子效应,最后以酶催化为结尾。 - 过去90年的克莱森重排
安娜·m·Martín卡斯特罗
化学评论2004年,104(6), 2939 - 3002
DOI:10.1021 / cr020703u
本文对Claisen重排反应进行了全面的综述,列举了大量的例子,说明了该反应的底物范围和在化学中的应用。 - 5β-CHOLEST-3-ENE-5-ACETALDEHYDE
R. E.爱尔兰和D. J.道森
Org。Synth。1974年,54, 71年
DOI:10.15227 / orgsyn.054.0071
一个涉及串联克莱森重排的程序示例。这是来自有机合成,一个独立测试的有机化学程序的可靠来源。经典Claisen重排的几个变体已经被开发出来了-下面是最流行的两个: - 简单立体选择版的克莱森重排导致反式-三取代烯烃键。角鲨烯的合成
威廉·萨默·约翰逊,卢修斯·韦特曼,威廉·r·巴特利特,蒂莫西·j·布罗克索姆,李宗tee, D.约翰·福克纳和迈克尔·r·彼得森
美国化学学会杂志1970年,92(3), 741 - 743
DOI:10.1021 / ja00706a07411
加热一个烯丙基的酒精与过量的正形乙酸三烷基在微量弱酸的存在下形成混合正形酯。机械上,矫形器失败了酒精生成烯酮缩醛,经过[3,3]- sigropic重排得到g,d-不饱和酯.这就是所谓的Johnson-Claisen矫形器重排它的发明者约翰逊(W. S. Johnson)教授建立了斯坦福大学的化学系。 - 烯丙基克莱森重排酯类
罗伯特·e·爱尔兰,理查德·h·穆勒
美国化学学会杂志1972年,94(16), 5897 - 5898
DOI:10.1021 / ja00771a062
烯丙基三甲基硅酮的重排缩醛树脂的反应制备的烯丙基的酯与TMSCl烯醇化。这被称为爱尔兰-克莱森(硅基烯酮)缩醛)以发明者罗伯特·爱尔兰教授的名字重新排列。这种反应的优点是可以在更温和的条件下进行。 - 对映选择性Claisen重排:第一代不对称酰基-Claisen反应的发展
特希克·p·尹和大卫·w·c·麦克米伦
美国化学学会杂志2001年,123(12), 2911 - 2912
DOI:10.1021 / ja015612d
这是克莱森重排的现代发展的一个例子。这是麦克米伦教授(普林斯顿)在不对称Claisen重排领域发表的几篇论文之一。
非常感谢你发布这一课。我学到了很多。