烯醇和烯醇酯
克莱森凝聚和狄克曼凝聚
最后更新:2022年11月14日|
Claisen缩合(及其分子内版本,Dieckmann缩合)
- 的克莱森缩合的基本反应之一吗酯类.
- 在Claisen缩合中,an酯(2个等价物)用基地(相当于1);这个产品叫做"beta-keto”酯,因为酮离碳有两个碳酯羰基.
- 它形成了一个新的碳碳键并破坏了碳氧键和碳氢键。
- Dieckmann凝聚是一种分子内的形成5元环或6元环的克莱森缩合。
这里有一个具体的例子:
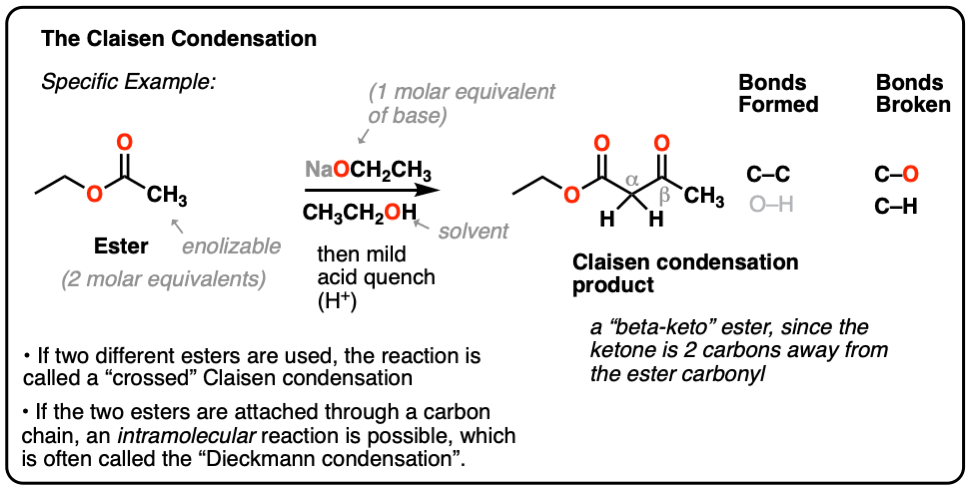
当两个不同的酯类都参与了,这种反应通常被称为“交叉”克莱森。
像许多反应一样,克莱森有一个分子内它被称为Dieckmann缩合,尽管它仍然是相同的反应,经历相同的机制。车上的铭牌不同,引擎盖下的引擎相同。
学习这种机制是很重要的,因为它包含了许多关键的反应性质酯类-去质子化烯醇化物烯醇化物的作用的亲核试剂,以及如何酯羰基可以接受addition-elimination反应(即。亲核酰基取代)
在这篇文章中,我们将详细展示克莱森凝聚机制的每一步,以及交叉克莱森凝聚和Dieckmann凝聚的例子。最后会有一些测试题,测试你对一些关键概念的理解。
目录
- 克莱森凝结
- 强碱脱质子生成酯烯醇
- 羰基的亲核加成和消除(又称亲核酰基取代)
- 酮酯产物的脱质子反应
- 交叉克莱森凝聚
- 分子内Claisen缩合- Dieckmann反应
- 结论:Claisen和Dieckmann
- 笔记
- 测试你自己!
- (高级)参考资料和进一步阅读
1.克莱森凝结
当一个酯(2摩尔当量)用强碱(1摩尔当量)处理,得到了新产物,关键结果是形成了新的C-C键,C-H键和C-O键被打破。
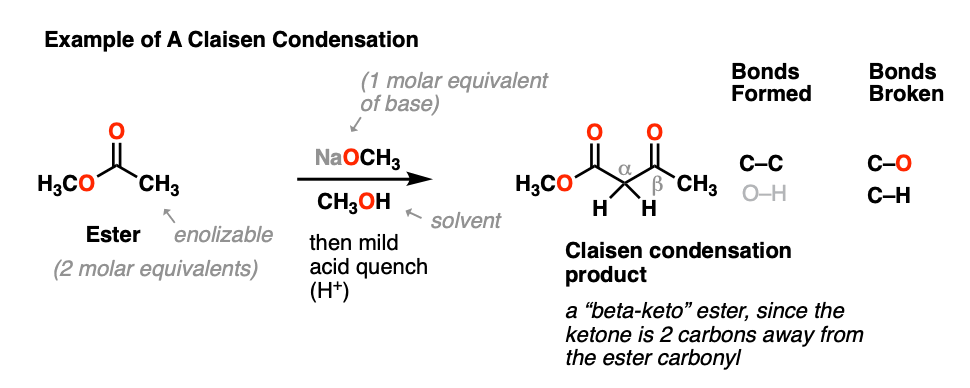
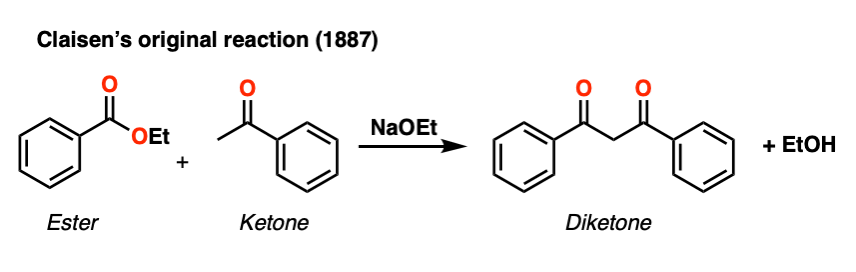
这个一般过程被称为克莱森缩合,以路德维希·克莱森命名,他是19世纪德国化学家(以克莱森重排和克莱森改编者闻名),他在1887年报告了这个反应。[注1]
这个反应是两个反应的结合酯类通过新的碳碳键结合,形成一种新产物,叫做-酮酯,因为a而得名酮位于离的两个碳(“贝塔”)酯羰基.
当然,专注于关键结果(形成C-C,打破C-H和C-O)就像以最后一幕开始一部电影。问题是,我们是怎么做到的?
正如我们将看到的,克莱森的机制是通过一些关键功能的伟大之旅酯类比如它们与碱反应生成烯醇酯,烯醇酯如何作为亲核试剂,如何酯羰基能和亲核试剂发生加成-消除反应,最后生成的产物(-酮酯类)最终会比开始时酸性大得多酯类,其中还加入了一个热力学水槽。
2.强碱脱质子生成酯烯醇
a相邻的碳羰基被称为"α碳”。当α碳有碳氢键,据说是enolizable,因为去质子作用会产生一种叫做an的物质烯醇化物.酮的-碳,酯类,其他相关分子比烷烃的C-H键酸性强几个数量级,因为碳上产生的负电荷可以通过共振离域到氧上。
的pK一个的α碳的酯类大概有25个,也就是10个6到107酸不如酮(pK一个大约18)。用NaOCH这样的强碱处理3.的去质子化α碳可以发生,导致其烯醇化物.
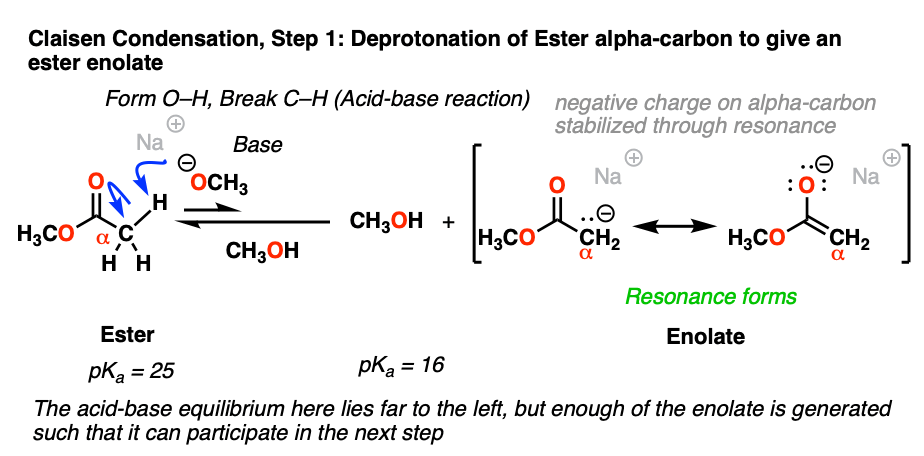
尽管平衡有利于起始物质烯醇化物乘以8pKa单位(即10个左右)8:1),结果烯醇化物在接下来的加法步骤中反应性足够强吗酯被转换成最终产品。
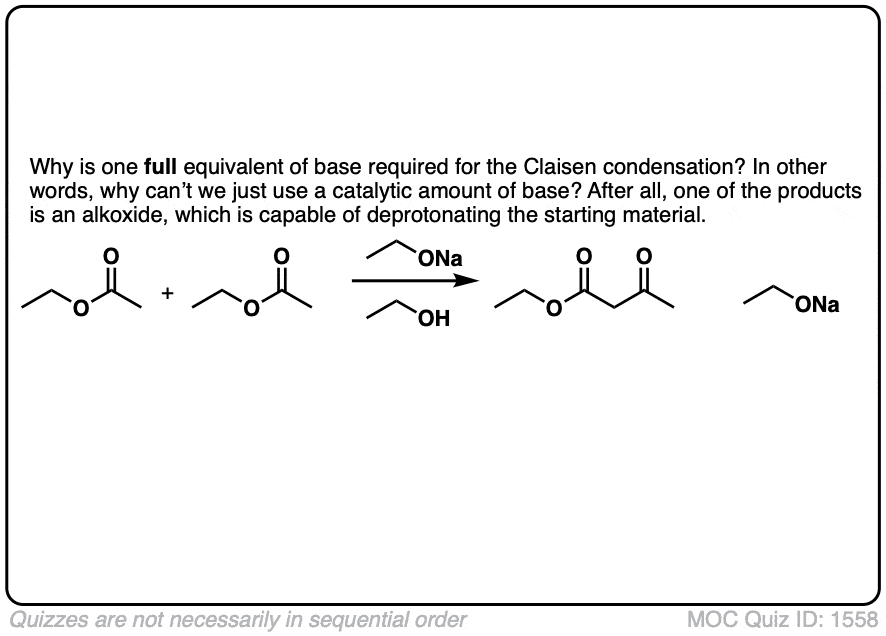
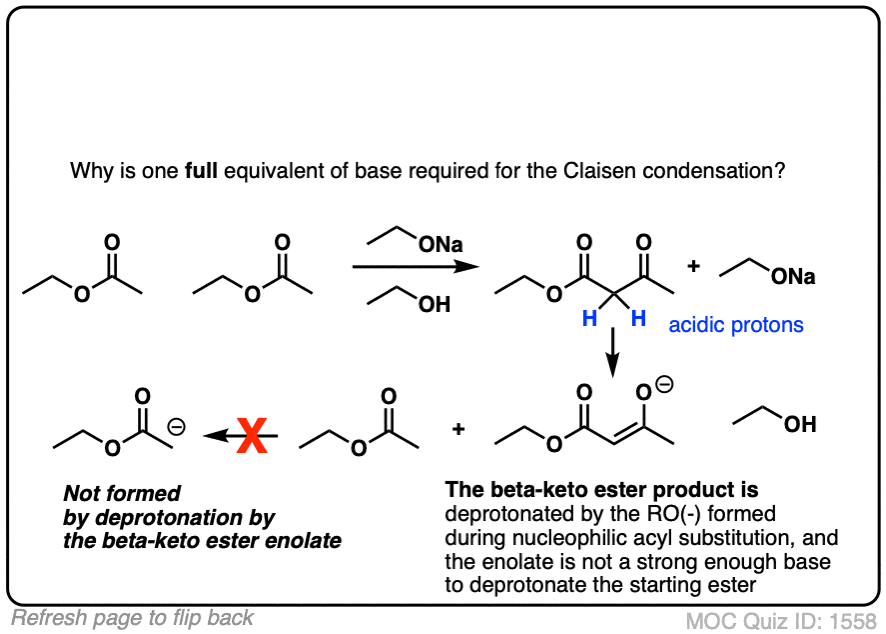
的醇盐基(RO-)通常被选择来匹配酯或者组。你觉得这是为什么呢?[请看下面的测验]
3.羰基的亲核加成和消除(又称亲核酰基取代)
正如我们之前多次看到的,烯醇酯是很好的亲核试剂,作为亲核试剂,它们倾向于在碳.[注2]
的烯醇化物碳会攻击最好的亲电试剂Present,恰好是羰基碳的另一个等价的的酯.
这代表了迄今为止最重要的机制羰基组:亲核加成(或者,“1,2-加法”)。随着亲核试剂形成一个新的纽带羰基碳,碳氧PI键断裂,产生a四面体中间.
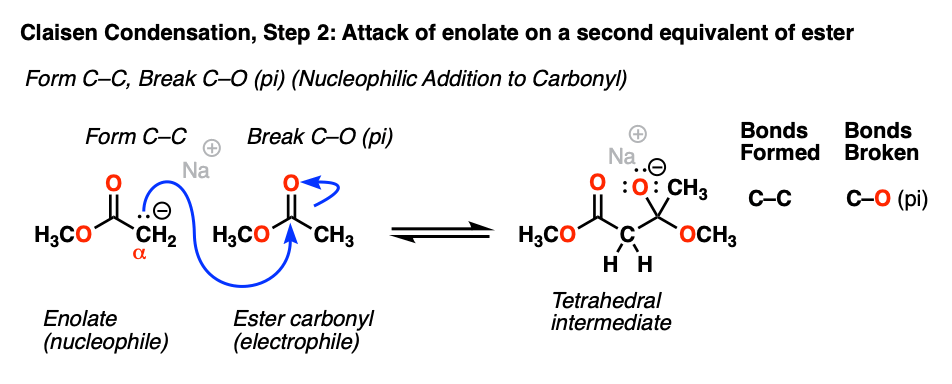
[注意这个反应是可逆的。在四面体中间体和起始物质之间存在一种平衡酯烯醇化物+酯)。)
现在我们来看第二重要的反应羰基功能组:消除(或者,1,2-消去法)。四面体中间体中氧的负电荷可以重新形成碳氧键,并在这样做破坏C-O键.结果是一个新的酮和一个醇盐(罗- - - - - -)离去基团:
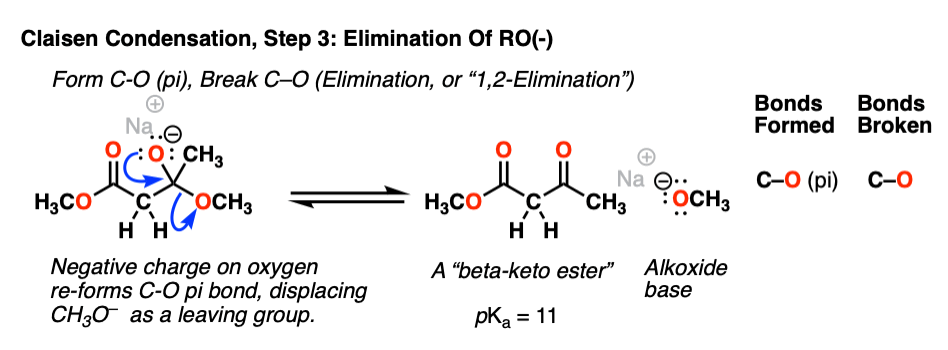
通常人们不会想到醇盐作为一个好的离去基团(pK一个乙醇的浓度是16,生成CH3.CH2O- - - - - -强碱),但消除RO(-)仍然是一个比逆转更有利的途径加成反应给予酯烯醇化物(pK一个的酯= 25)。[注3].
第2步和第3步合起来称为"亲核酰基取代的“或”酯已被CH2有限公司2R。
这1-2次加减反应是酰基组(RC(O) -)我们会一次又一次地看到它。
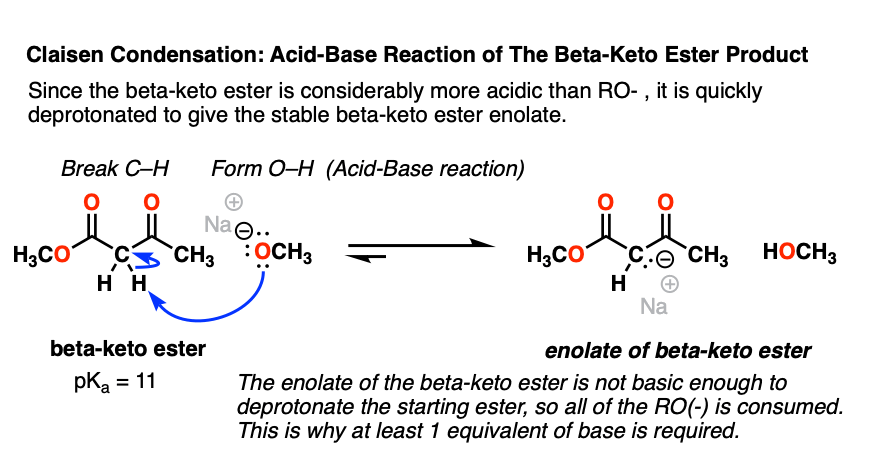
4.酮酯产物的脱质子反应
已经展示了亲核酰基取代如何发生在Claisen,我们的反应机制是近完成了。然而,还有一个棘手的问题需要解决。
我们看到亲核酰基取代在酯生成新的强碱RO(-)。
碰巧克莱森的产物,酮酯是一种相当强的酸(pK一个11)比……共轭酸RO(-), ROH (pK一个16)。
我们在酸碱反应中见过无数次了,a更强的酸加上更强的碱会得到更弱的酸和更弱的碱。(参见:有机化学中的酸碱反应]
这意味着醇盐碱很容易使生成的-酮脱质子酯,给予新烯醇化物-酮的酯.
为什么是-酮酯(pK一个11)那么酸?注意,碳上的负电荷现在可以通过碳去离域了两个不同的氧,它们的电负性更强,更能稳定负电荷
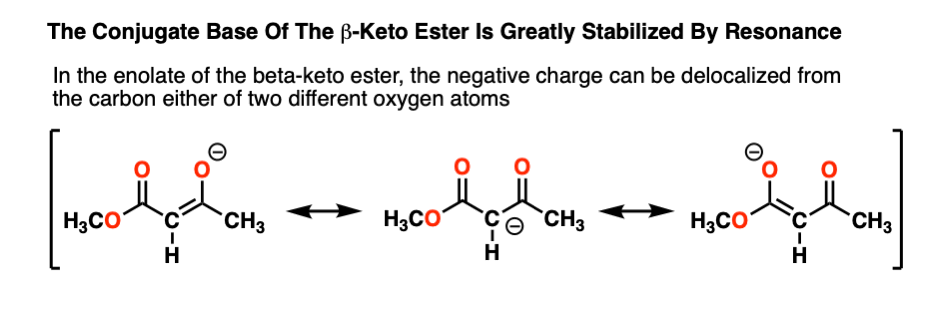
一般来说,负电荷越“分散”,它就越稳定。“负电荷的不稳定性”通常与高碱度相关,反之亦然。
的烯醇化物是如此稳定,事实上,它代表了化学家通常所说的“热力学汇”。一旦形成,回到起始物质的平衡是非常不利的烯醇化物只是放在反应瓶里,没有发生任何显著的反应。[注意4]
在这方面,它就像流入水槽或水桶的水,必须“向上”流动才能流出。正如所有的河流都流入大海,在海森凝结,我们所有的酯起始材料最终转化为烯醇化物酮的酯.[注5]
值得注意的是烯醇化物酮的酯这样的弱碱是否不能使任何起始物脱质子酯(pK一个= 25)。这就是为什么为了使反应继续进行,我们必须使用碱:至少一个完全等量的碱.[顺便说一下,这与Aldol反应相反,Aldol反应只需要催化碱,因为反应产生RO(-)]
一旦形成,就无事可做烯醇化物酮的酯就放在反应瓶里,直到加入温和的酸来熄灭反应。
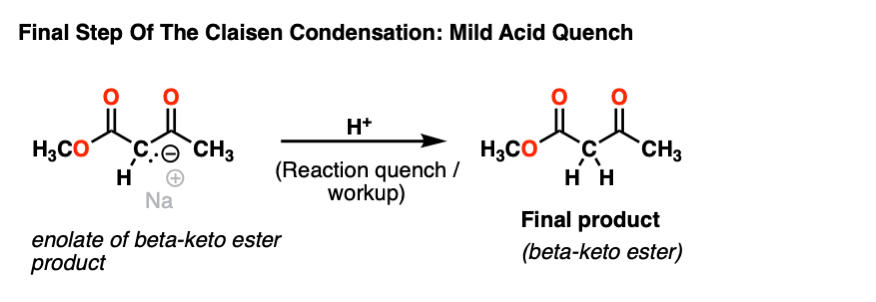
这就得到了-酮酯产品。
5.“交叉”克莱森凝聚体
两个相同的组合酯类很好,但更好的是把两个连在一起不同的酯类.
这是可以做到的,它被称为“交叉”克莱森凝聚。这里有一个例子:
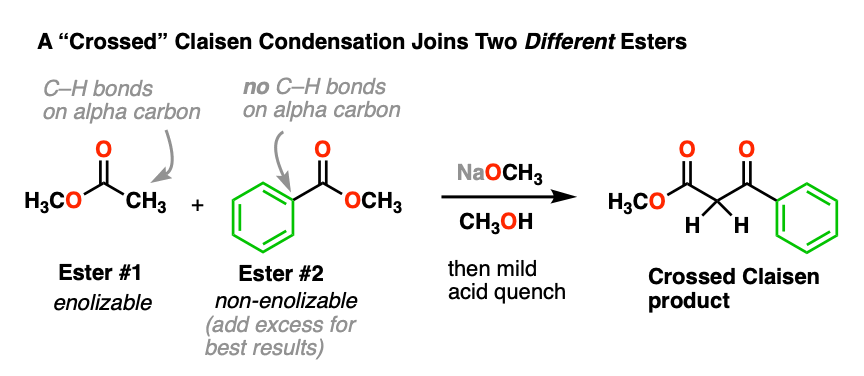
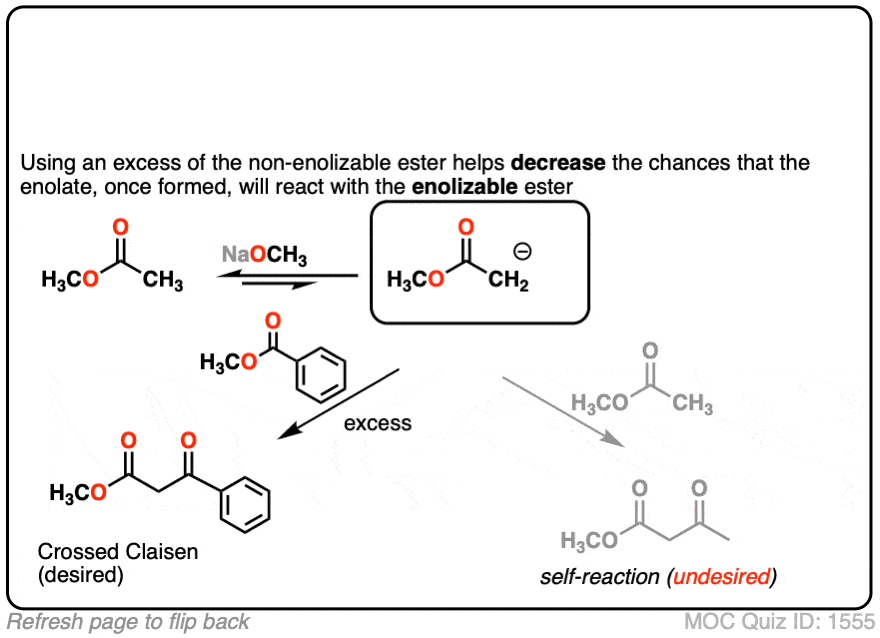
在这个反应中,我们有两个不同的酯类,但请注意,只有一个是“enolizable——也就是说,有一个α碳与碳氢键结合,因此能够形成烯醇化物.这大大简化了事情,因为只有一个烯醇化物亲核试剂可以形成.我们可以通过增加多余的非基因来增加克莱森杂交的几率enolizable酯.
- 为什么你认为增加多余的“non-”会有帮助enolizable”酯?[看到测试].
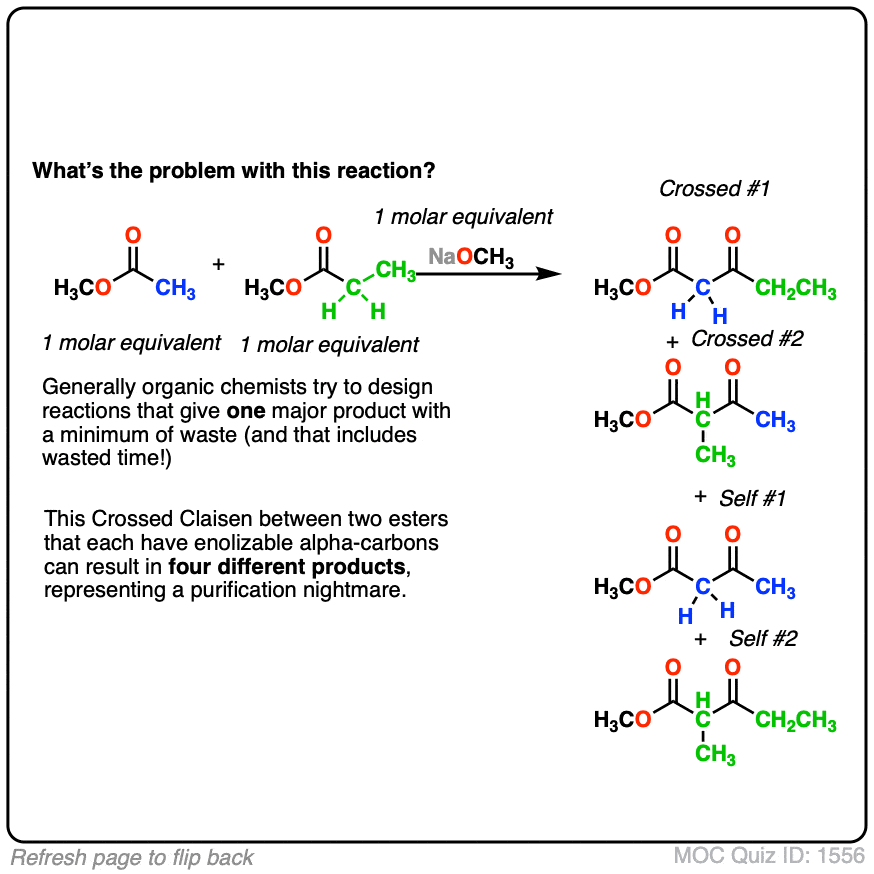
- 为什么使用两个可能是一个坏主意enolizable酯类?[看到测试]
6.分子内Claisen缩合- Dieckmann反应
我们之前见过很多次,如果a亲核试剂和一个亲电试剂通过中间的碳链相互连接,结果就会形成一个新的环。
克莱森也不例外。虽然由于历史原因,这个版本的克莱森通常有一个不同的名字- Dieckmann缩合,以某个W. Dieckmann的名字命名,他在20世纪初因研究这种反应而闻名。名字并不重要;这是相同的反应,只是分子内反应。正如莎士比亚曾经说过的,任何其他名称的反应仍然会形成并破坏相同的化学键。[注5]
这和我们在第一节中经历的过程是一样的。首先,an的去质子化α碳给…烯醇化物.第二,攻击的烯醇化物在一个酯.自亲核试剂和亲电试剂通过碳链连接,形成一个新的环。
下面是Dieckmann的一个例子:
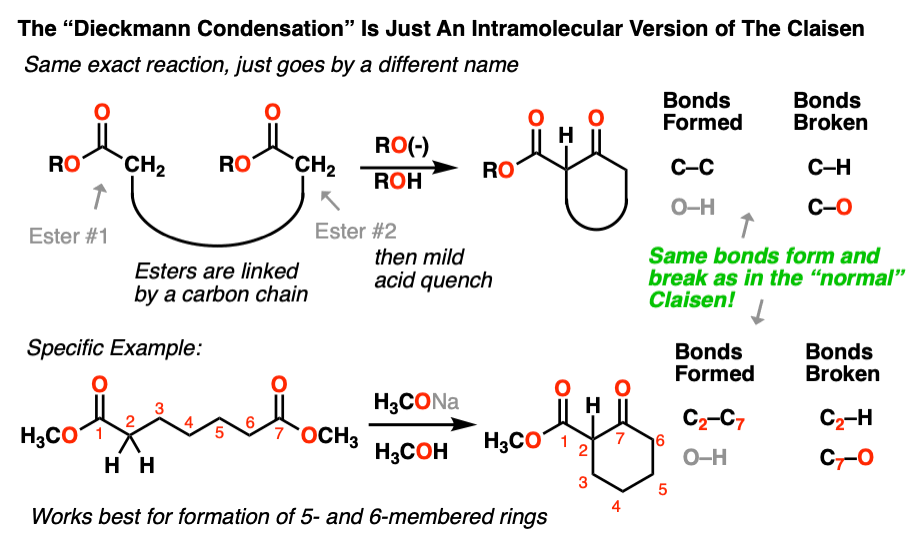
和我们遇到的其他分子内反应一样,这个反应在形成五元环和六元环时效果最好。
你现在可能已经知道这个了,但是当你在这个网站上读到一篇关于“分子内”反应的文章时,它通常的意思是,“期末考试小心这个”。
要了解完整的机制,徘徊在这里然后会弹出一张图片或者点击这个链接.
7.结论:Claisen和Dieckmann
以下是我们对克莱森凝聚的了解:
- 酯烯醇酯可以与醇氧化合物形成,它们是很好的亲核试剂
- 酯类能和亲核试剂发生加成-消去反应,又称亲核酰基取代。在克莱森凝结亲核试剂中华民国(O)是CH2取代(RO-)的基团。
- 醇氧基在这种情况下是足够的离去基,因为它们是弱得多的碱酯烯醇化物。
- 克莱森缩合反应的产物是-酮酯,这是一种明显更强的酸(pK一个= 11)比任何一种醇(pK一个= 16-17)或酯类(pK一个= 25)。
- 这个反应至少需要一个等量的碱,因为烯醇化物酮的酯生成物的碱不够强,不能使起始产物脱质子酯.
- “交叉”克莱森凝结涉及烯醇化物一个酯作为一个亲核试剂用不同的(理想情况下是非enolizable)酯生成-酮酯.
- 当烯醇化物而且酯在同一个分子上,克莱森缩合就会形成一个环。这种分子内Claisen被称为Dieckmann缩合,最适合形成5元环和6元环。
笔记
注1。虽然本科教材中的“克莱森缩合”一词通常指的是化学反应酯烯醇化物与另一个酯早在1863年,格瑟就用乙酸乙酯制出了乙酸乙酯。克莱森在1887年的贡献是将这一过程推广到其他烯醇化物;例如,克莱森1887年的论文有一个酮烯醇化物用酯.Claisen也为理解这一机制做出了重大贡献。
注2。格罗斯曼的“次优”的规则很方便知道:次优共振结构往往是理解这种化合物的化学行为的关键。从。”合理有机反应机制的写作艺术”,2。因此,即使“最好的”烯醇化物共振形式是氧带负电荷,“次优”(碳带负电荷)决定了反应性。
注3。基础越弱,效果越好离去基团.(参见:什么是好的离去基].所以尽管我们通常认为RO-是很糟糕的离去基团(共轭碱乙醇,pK一个16)它仍然把裤子打掉了酯烯醇化物(共轭碱一个酯, pK一个25)就…而言离去基团能力。
注4。你可能也想知道,如果烯醇酯是很好的亲核试剂,为什么这个不与酯羰基,就像酯烯醇化物呢?一些附加到酯羰基可能会发生,但亲核攻击后,四面体中间体(较强的碱)会迅速恢复到起始状态烯醇化物(弱碱)+酯.因为所有的反应都处于平衡状态,而酮酯烯醇化物所有物质中最弱的碱是平衡的吗,酮酯烯醇化物是反应中的“热力学汇”。
注5。公平地说,Dieckmann除了对Claisen缩合的分子内版本的发展做出了贡献之外,他还对Claisen反应的一般可逆性做出了重要的发现。(见英格尔德,第1173页,提供有用的说明]
反应的可逆性变得越来越重要α碳变得越来越被取代。有趣的是克莱森在-酮的情况下不起作用酯不能enolize。比如这个:
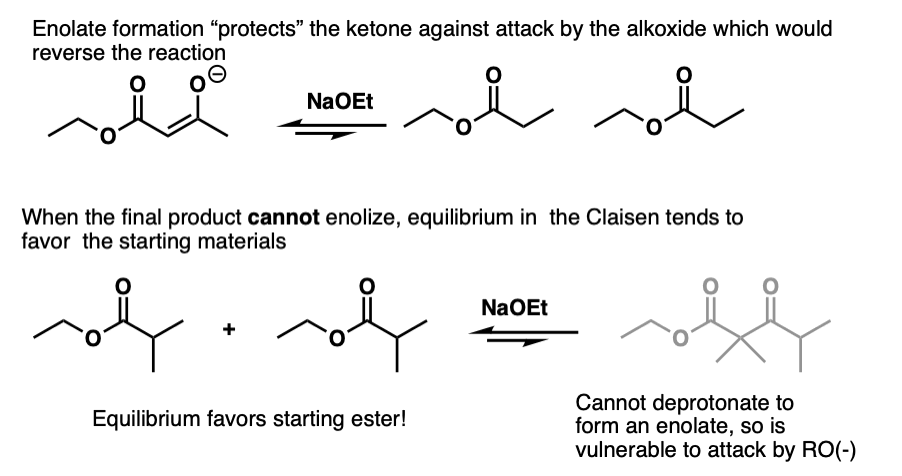
问题不在于克莱森不能最终产物会发生逆反应,使产物破裂。
形成烯醇化物因此有助于“保护”酮抵抗亲核试剂的攻击不仅从酸碱的角度来看是热力学的而且还有助于抵抗亲核试剂的攻击。
测试你自己!
1.在克莱森缩合反应中,碱(RO-)和酯.如果它们不同会发生什么?
 点击翻转
点击翻转
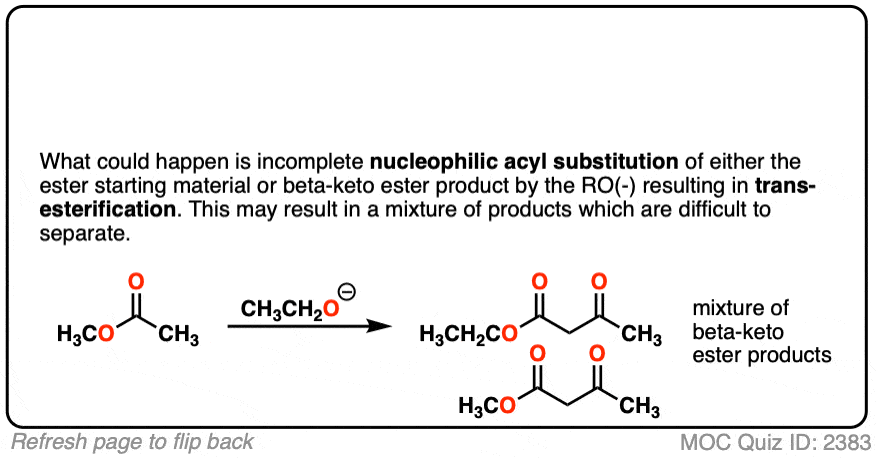
2.在交叉克莱森反应中,只有一个酯是enolizable,而非enolizable酯被过量加入。为什么用non-enolizable酯在过剩?
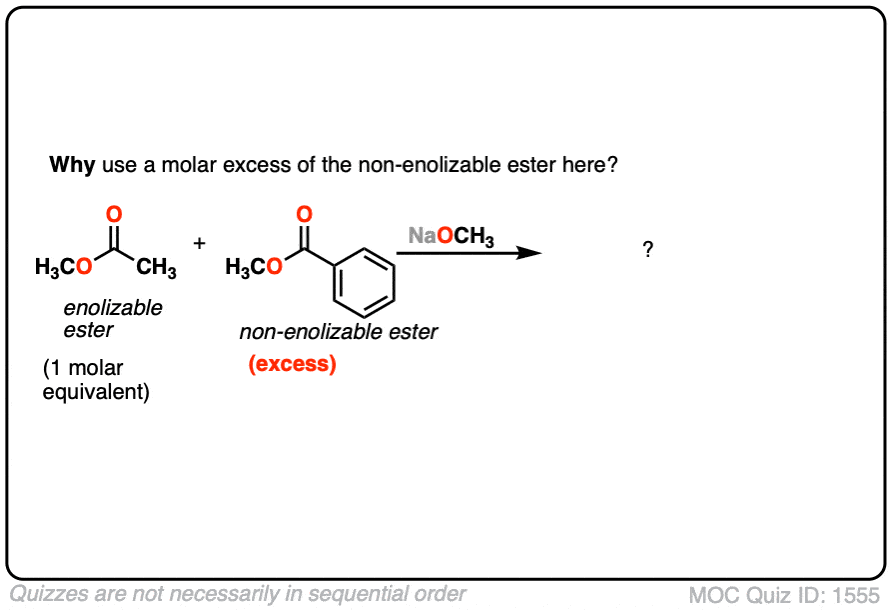 点击翻转
点击翻转
3.如果我们用两个会发生什么enolizable酯类等量吗?
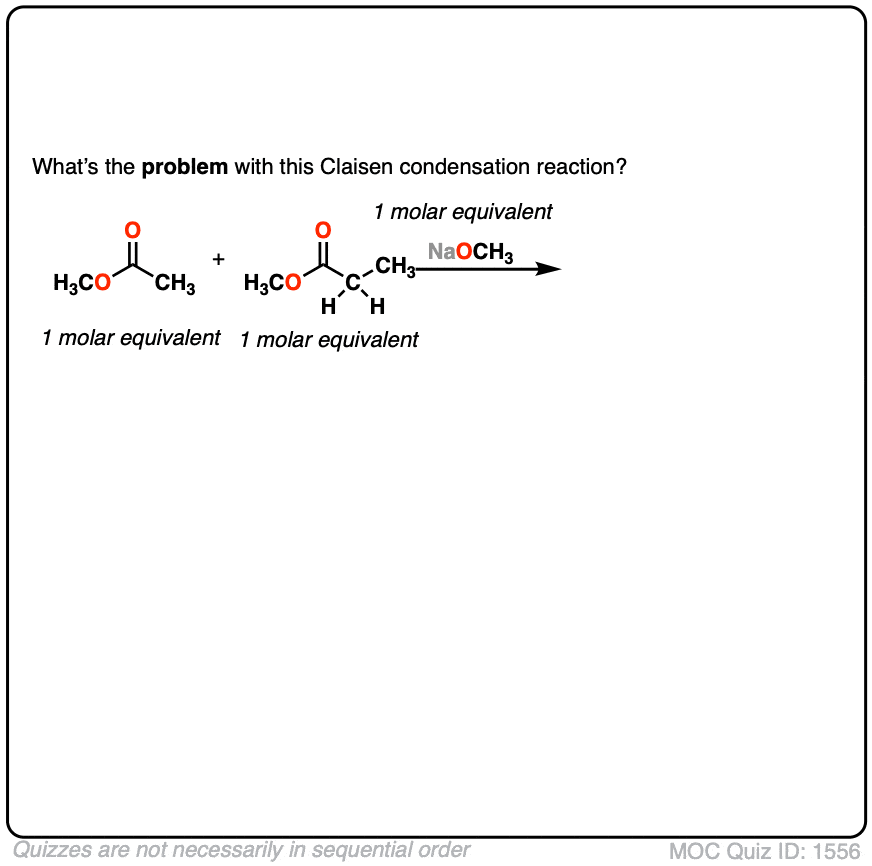 点击翻转
点击翻转
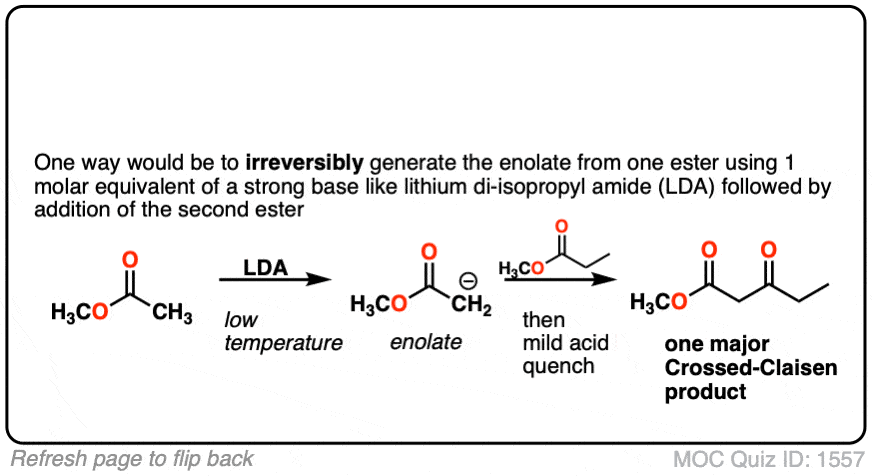
4.你能想出一种变通方法来成功地进行交叉Claisen,从而只获得一种产品吗?
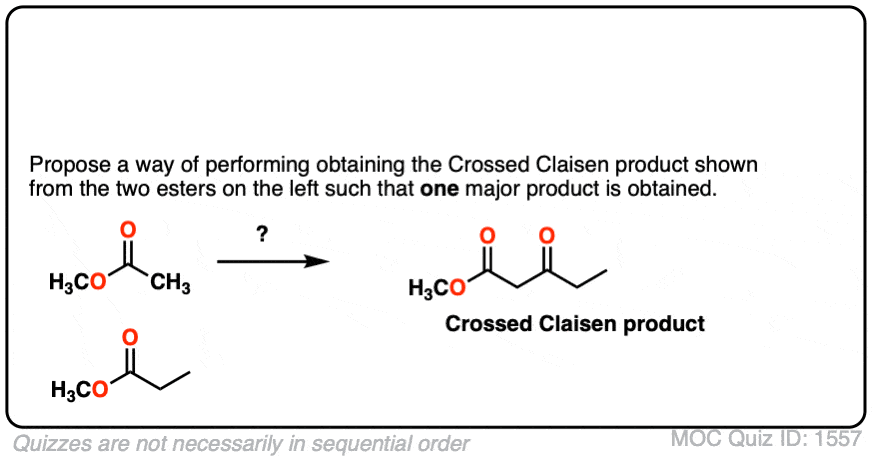 点击翻转
点击翻转
 点击翻转
点击翻转
6.一位化学家试图合成如下的-酮酯通过Dieckmann凝聚,但不成功。为什么不会发生Dieckmann凝聚?
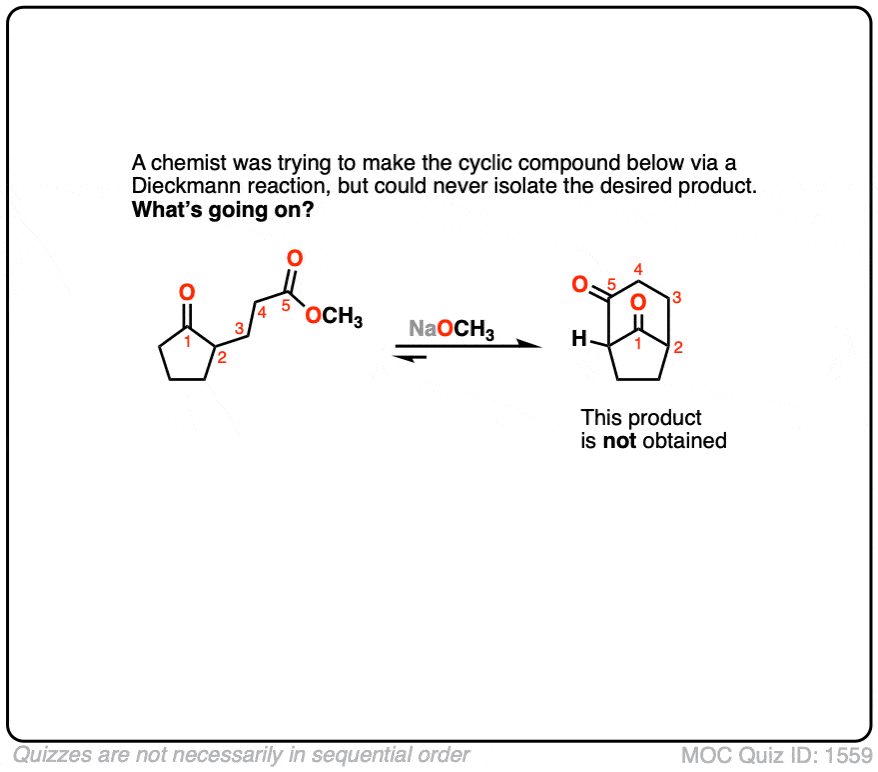 点击翻转
点击翻转
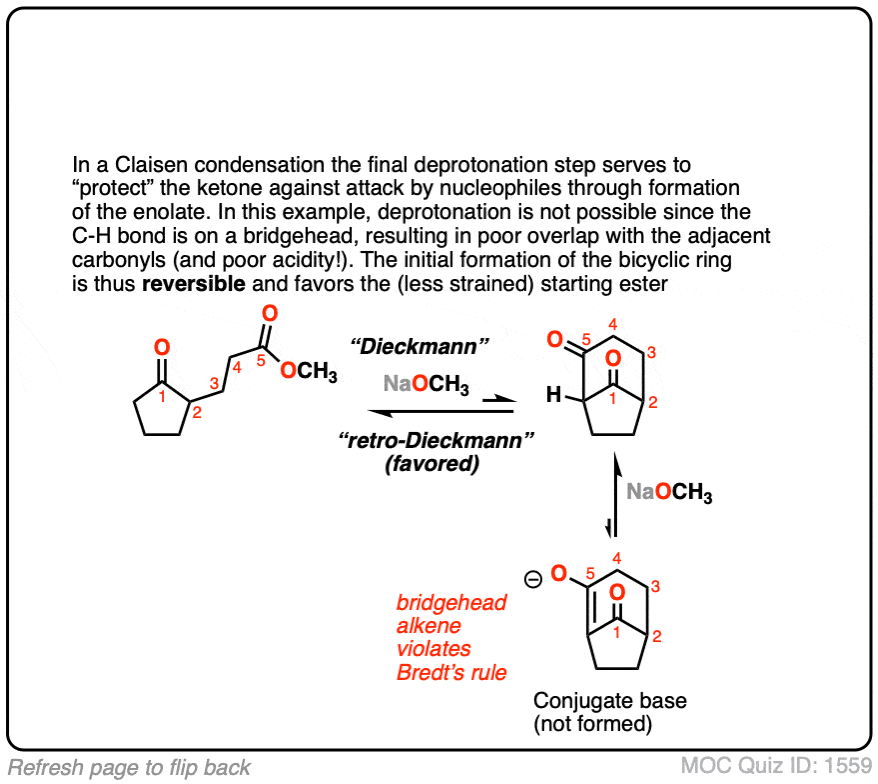
(高级)参考资料和进一步阅读
克劳森缩合也被称为克劳森-格瑟反应,这是在路德维希·克劳森和a·格瑟第一个发表这种转变的人之后。
- Untersuchungen über die einbasischen Säuren
答:Geuther
拱门。制药。1863,166(2), 97 - 110
DOI:10.1002 / ardp.18631660202
这个反应的原始报告后来被称为克莱森缩合反应。由乙酸乙酯和碱生成乙酸乙酯。 - Ueber死Einführung冯Säureradicalen在酮
l·克莱森
化学。的误码率。1887,20.(1), 655 - 657
DOI:10.1002 / cber.188702001150
这通常被认为是Claisen关于这个反应的第一个工作,尽管它似乎是一个反应之间酮烯醇化物和一个酯,而不是在酯烯醇化物和一个酯.见:https://zenodo.org/record/1425461 .X1EeLRNKh25
- 的乙酰乙酸酯缩合和某些相关反应
查尔斯·豪瑟;小哈德森,博伊德E。
Org。反应。1942,1, 266 - 302
DOI:10.1002/0471264180. or001.09
有机反应,由ACS有机化学部门出版和维护,是有机化学中各种转变的综合评论的来源。这篇特别的评论来自1942年的第一期,涵盖了直到那时为止已知的所有克莱森凝结的实例。最后给出了详细的实验步骤。的Dieckmann condensation is the intramolecular variant of the Claisen condensation. - Zur Kenntniss der Ringbildung aus kohlenstoffketen
w . Dieckmann
化学。的误码率。189427(1), 102 - 103
DOI:10.1002 / cber.18940270126
W. Dieckmann对该反应分子内变异的第一份报告。 - Ueber cyclische β‐Ketoncarbonsäureester
w . Dieckmann
而已。Lieb。安。化学。1901年,317(1), 27 - 109
DOI:10.1002 / jlac.19013170104 - Claisen缩合是合成α-烷氧基肉桂酸酯的捷径:乙酯(2S)-2-乙氧基-3-(4-羟基苯基)丙酸酯的合成
Mats T. Linderberg, Mikael Moge和Sivaprasad Sivadasan
有机工艺研究与开发2004年,8(6), 838 - 845
DOI:1021 / op040006z
有机工艺研究与开发(“OPRD”)也是一个寻找强大有机转化的好地方,因为反应需要清洁、高产,并且在扩大规模时不需要极高或极低的温度。 - 酰化的酯类、酮类和腈
布莱恩·r·戴维斯,彼得·j·高拉特
合成1991年,2, 795 - 863
DOI:10.1016 / b978 - 0 - 08 - 052349 - 1.00050 - 0
这篇综述涵盖了Claisen和Dieckmann凝聚,以及其他相关的化学。 - 碳青霉素类药物的对映性合成
Jonathan Z. Ho, Rafat M. Mohareb, Jin Hee Ahn, Tae Bo Sim和Henry Rapoport
有机化学杂志2003年,68(1), 109 - 114
DOI:10.1021 / jo020612x
Dieckmann缩合在现代有机合成中也有实用价值,因为它可以用作环化(环形成)反应,正如Henry Rapoport教授(加州大学伯克利分校)在全合成中所看到的那样。
如果我每月支付课程费用,我是否可以获得pdf指南?
不,pdf指南是一次性下载的,而每月订阅的是反应指南和测验,它们可能太大了,无法下载。
我不明白为什么RO不直接在第一步中攻击c=o中的碳进行亲核加成反应?
可以,但它是可逆的。就像开车走在死胡同里一样,最终它会折返到另一个地方。
嗨!问个小问题,如果酯用强碱处理反应不会变成皂化吗?
嗨,如果酯用氢氧根离子HO(-)处理,就会转化为羧酸(然后是羧酸盐),这就是皂化。
如果用醇氧基RO(-)处理酯,那么可能发生的不是皂化,而是酯交换,这是一种亲核酰基取代反应。例如,CH3COOCH3 + NaOCH2CH3可以得到CH3COOCH2CH3 + NaOCH3。
为了避免Claisen中的酯交换,我们通常使添加的碱与酯上的碱相同。