羧酸衍生物
亲核酰基取代(带负电荷的亲核试剂)
最后更新:2023年2月7日
亲核酰基取代(带负电荷的亲核试剂)
是的,有很多反应羧酸衍生品学习!在这篇文章中,我们将探索最重要的途径:亲核酰基取代.
不过,也有好消息:
- 与带负电荷的亲核试剂亲核酰基取代倾向于遵循一个简单的两步机制(添加-消除)
- 此外,无论出于何种目的,NAS反应的行为都很像酸碱反应。如果你还记得“强酸+强碱=弱酸+弱碱”,(也被称为酸碱平庸原则)你就能很好地预测一个给定的亲核酰基是否亲核取代反应将会发生。
目录
- 亲核酰基取代(NAS)
- 三种亲核酰基取代反应(效果很好)
- 带有负电荷的亲核试剂的亲核酰基取代的加成-消除机制
- 一些不可行的亲核酰基取代
- 当离去基是比亲核试剂弱的碱时,NAS反应是有利的
- 一些快速练习
- 羧酸…也是酸!
- 皂化
- 分子内亲核酰基取代
- 格氏试剂和LiAlH4增加两倍
- 中性亲核试剂与酸催化
- 总结
- 笔记
- 测试你自己!
- (高级)参考资料和进一步阅读
1.亲核酰基取代
亲核酰基取代一个反应是a吗亲核试剂形成一个新的纽带羰基一种酰基的碳,并伴有酰基间键的断裂羰基碳和a离去基团.
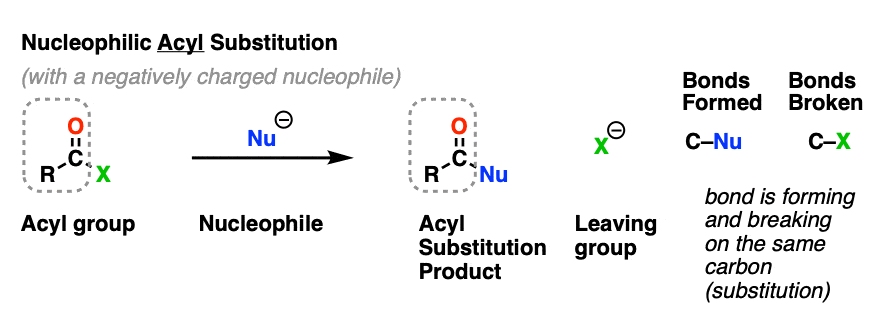
这被归类为a取代反应因为我们在同一个碳上形成和断开了一个键。碳-亲核试剂成键,还有一个碳离去基团键断裂。
虽然机制不同,亲核酰基取代表面上类似于我们以前见过的取代反应,如亲核脂肪族取代而且亲核芳香族取代.
看其他亲核取代反应家族或点击链接.
在这篇文章中,我们将具体介绍亲核酰基取代反应的例子带负电荷的亲核试剂.在后续的文章中,我们将介绍酸催化剂用于亲核酰基取代,如Fischer酯化反应、酯类,以及其他许多例子。
(中性亲核试剂,以及酸性条件下的亲核取代,见中性亲核试剂的加-消)
2.三种亲核酰基取代反应(效果很好)
这里有三个典型的亲核酰基取代反应的例子。
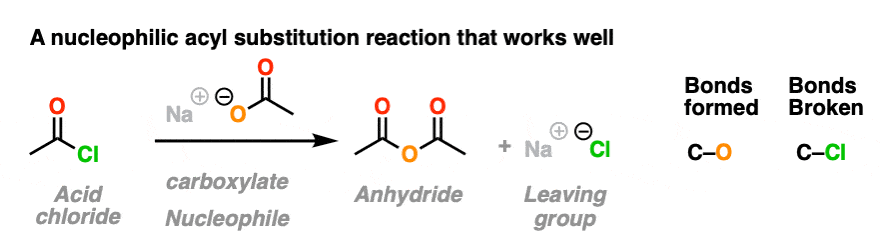
在第一种反应中,酸氯化物与羧酸发生反应(的共轭碱羧酸,作为a亲核试剂在这里)给…酐.一个新的C-O键形成,一个C-Cl键断裂。
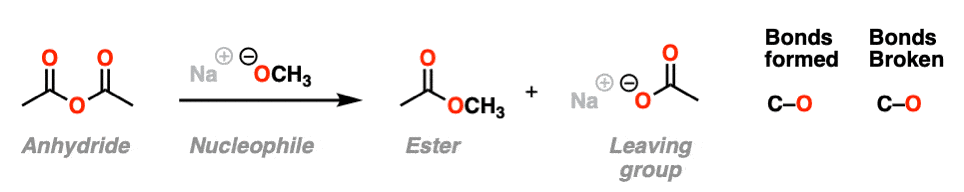
在第二个例子中,我们用an来处理酸酐醇盐形成一个新的酯.碳氧键形成,碳氧键断裂。在这种情况下羧酸盐是我们的离去基团.
第三个例子涉及使用体积较大的氢化物源二异丁基氢化铝(DIBAL-H)到an酯在低温下形成醛.一个新的C-H键形成,一个C-O键断裂。
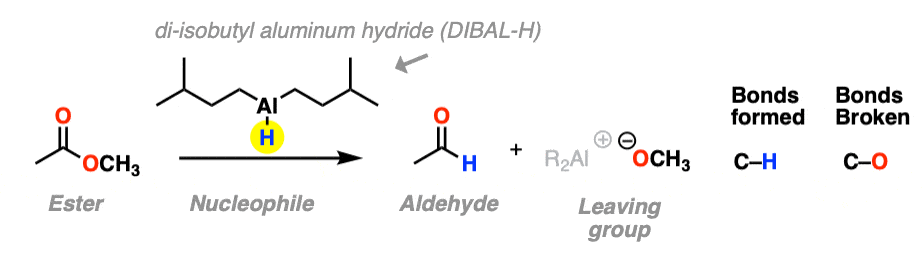
在低温下(-80°左右),这工作得很好;较高的温度会导致过度还原。[请注意1]
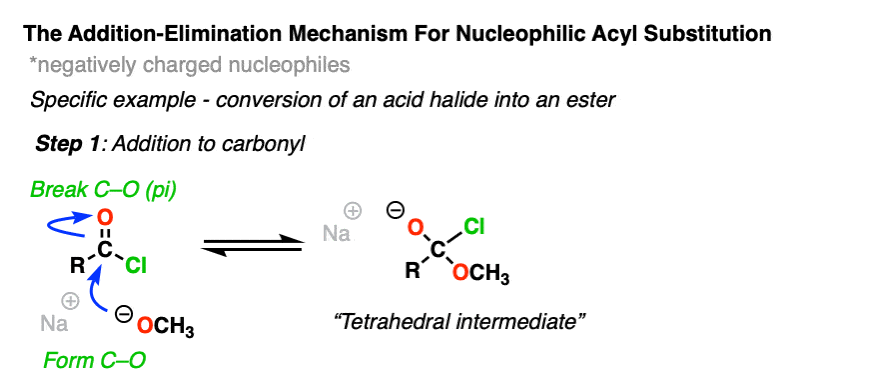
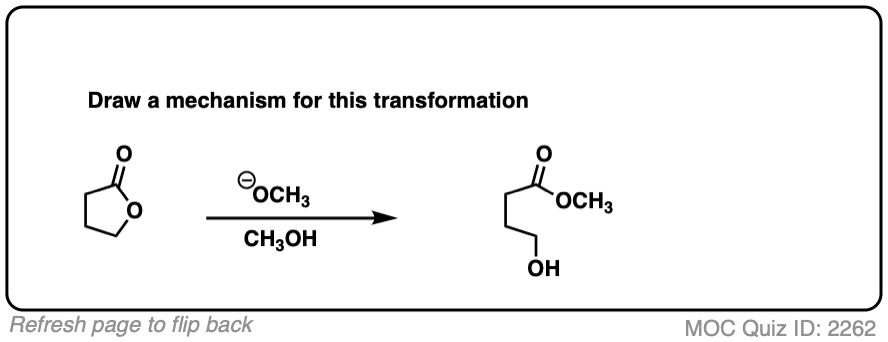
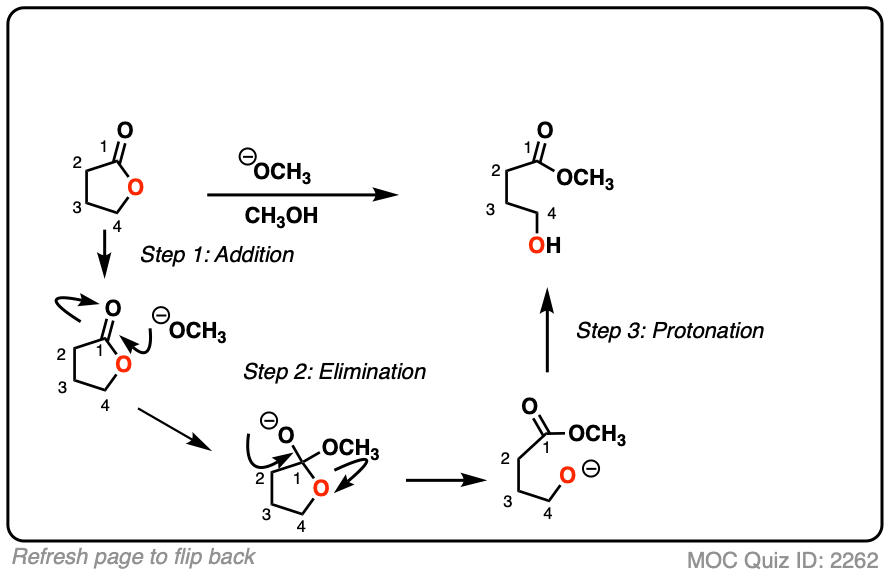
3.带有负电荷的亲核试剂的亲核酰基取代的加成-消除机制
那么这些反应是如何起作用的呢?它们不是SN2型反应,因为SN2只对sp有效3.杂化碳原子。它们也没有被确定为SN1型反应离去基团先离开,然后亲核试剂攻击(尽管这描述了傅克酰化很好!)
相反,实验提供了强有力的证据,可以分为两步addition-elimination通过a的机制四面体中间。[请注意2]
第一步应该非常熟悉醛和酮的反应。[看到,醛酮7个关键反应的简单两步模式
C=O基团的碳是亲电并且很容易与负电荷发生反应亲核试剂通过一个除了机制(步骤1,形成C-Nu,打破C-O (pi)]
现在怎么办呢?通过加法机制的反转,也就是它的名字消除,四面体中间体可以还原到起始物质,重新生成起始酰基。
或者,如果我们有一个足够好的离去基团,消去会导致C-O π键的重新形成,失去a离去基团.
[步骤2,形成C-O (pi),打破C-LG
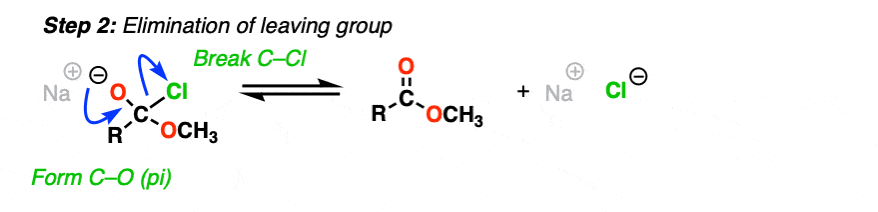
结果是a替换发生。
这个两步机制被称为addition-elimination这在化学中非常普遍羧酸衍生物(即酰基)。在中立的情况下亲核试剂使用或存在酸性催化剂时,一些介入的质子转移步骤可以延长该机制(例如。P一个DPED),但核心过程仍然是加减。(更多信息羰基淘汰-见Addition-Elimination)
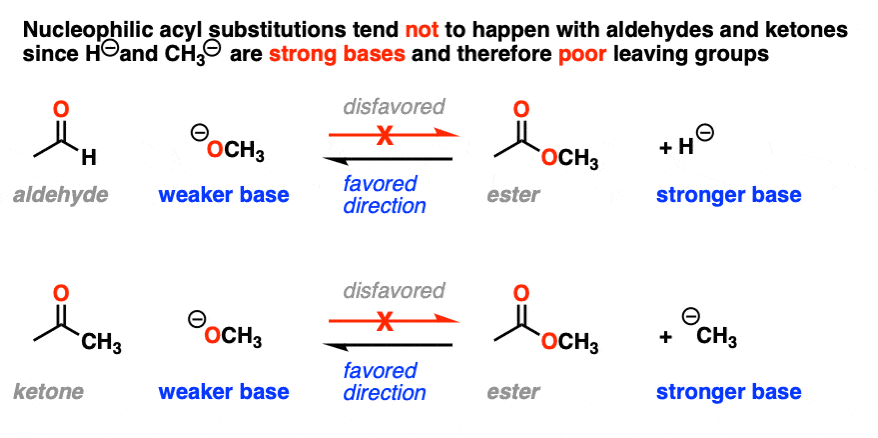
4.不起作用的亲核酰基取代
到目前为止,一切顺利,对吧?我们只需要加上亲核试剂连着酰基。的亲核试剂增加了,离去基团叶,我们得到了新的取代积。简单!
这里还有两个亲核酰基取代反应的例子。
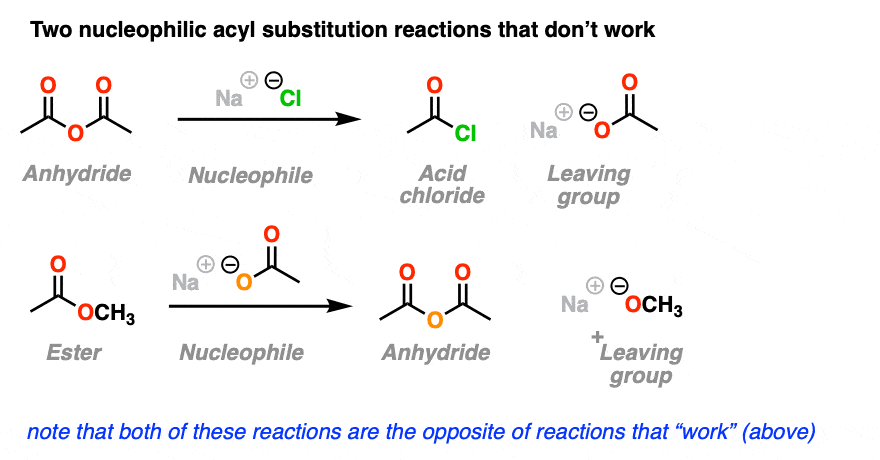
你可能已经注意到,这里显示的反应与上面一节中“有效”的亲核取代反应完全相反,只是我们交换了恒等式亲核试剂和离去基团.
问题是,虽然你可以在纸上画出这些亲核酰基取代反应,但在现实世界中,你可以等着大陆漂移发生泛大陆二世但它们仍然不会发生。
那么为什么亲核酰基取代倾向于一个方向而不是另一个方向呢?
5.当离去基是比亲核试剂弱的碱时,NAS反应是有利的
让我们简单地回到组织1,在那里我们学习了酸碱反应的黄金法则,也被称为酸碱平庸原则:酸碱反应的有利方向是a更强的酸反应与强大的基础给…较弱的酸和一个较弱的基础.(看到帖子:如何使用pKa表)
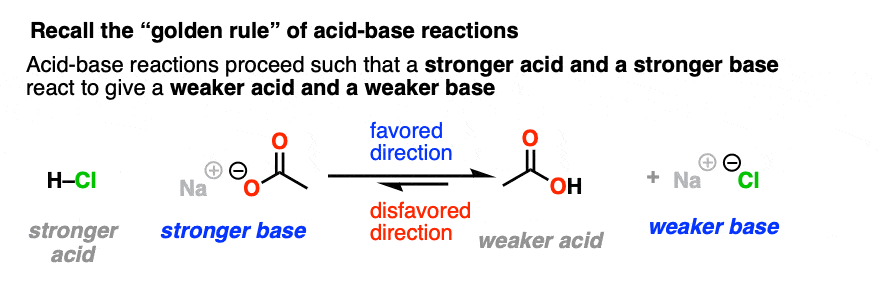
我们直观地知道,在水中加入食盐不会产生大量的HCl气体和腐蚀性的氢氧化钠,而在NaOH颗粒中加入浓缩的HCl是清醒的人在没有很多安全预防措施的情况下不会做的事情。
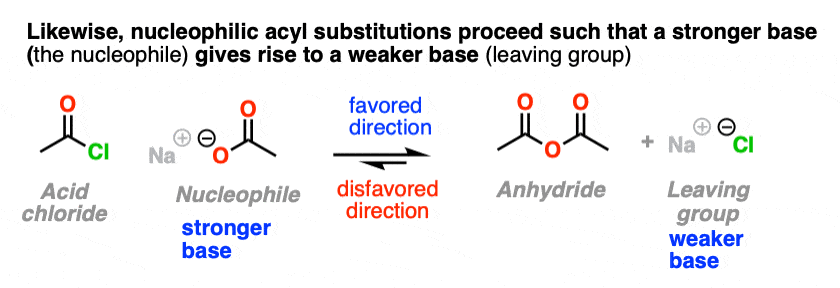
所以当考虑亲核酰基偏向哪个方向时取代反应,预计它将有利于弱碱的形成.
就像水向下流动一样,NAS反应也会“流动”,比如产生更稳定的阴离子(较弱的碱)。
(将“弱碱”理解为“更稳定的电子对”的另一种说法可能也会有所帮助。)
这也有助于我们理解为什么亲核酰基取代反应对醛和酮不起作用;就会形成氢化物离子(H-)或碳化物离子(R -),它们都是强碱。[注3]
如果我们用图表的形式表示pK,可能会有帮助一个(共轭酸)与亲核试剂/离去基团.
反应涉及一个“下坡从…流出亲核试剂来离去基团是受欢迎的,而那些需要“上坡”转换的较弱的基础到较强的基础将是不好的.
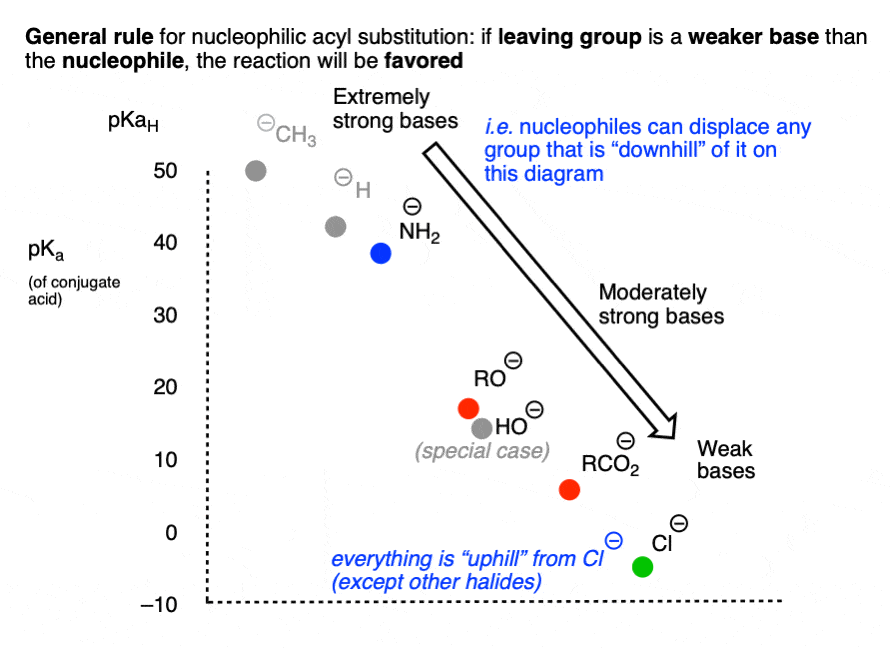
另一种表达相同想法的方法是做一个像下面这样的图表,其中最弱的碱(Cl-)不能进行任何亲核酰基取代反应,这可能会导致更强的碱:
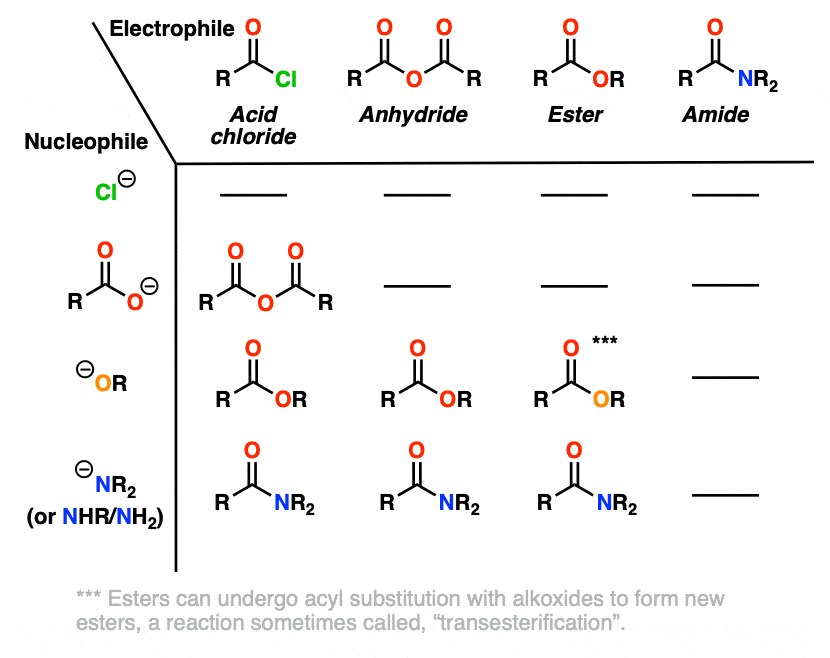
由于很快就会清楚的原因,在这张图中省略了HO(-)。[注意4]
悬停在此链接上可查看简化的反应能图或者点击这个链接.
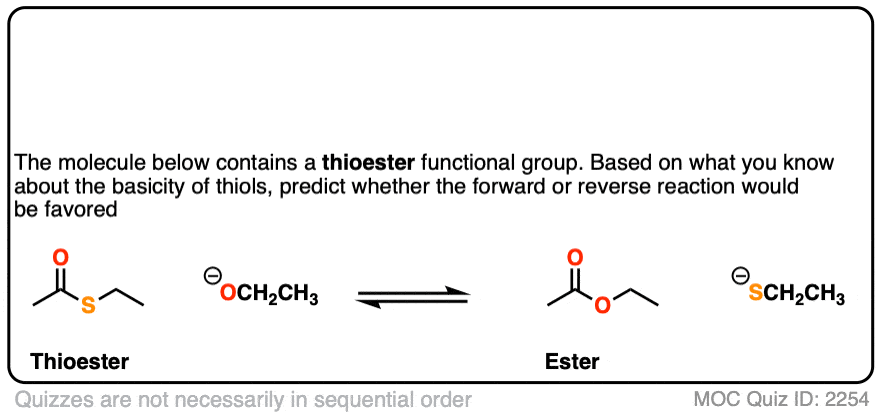
6.一些快速练习
为了让这个概念根深蒂固,为什么不做一些快速的练习来测试自己呢?
首先是硫酯。
 点击翻转
点击翻转
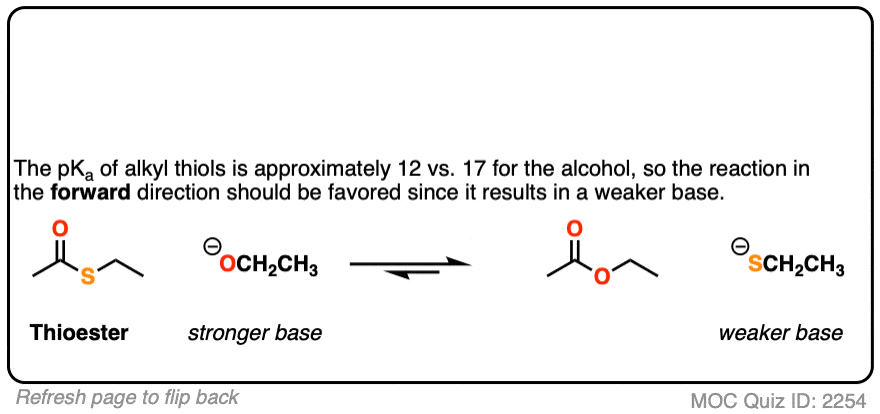
[注5]
 点击翻转
点击翻转
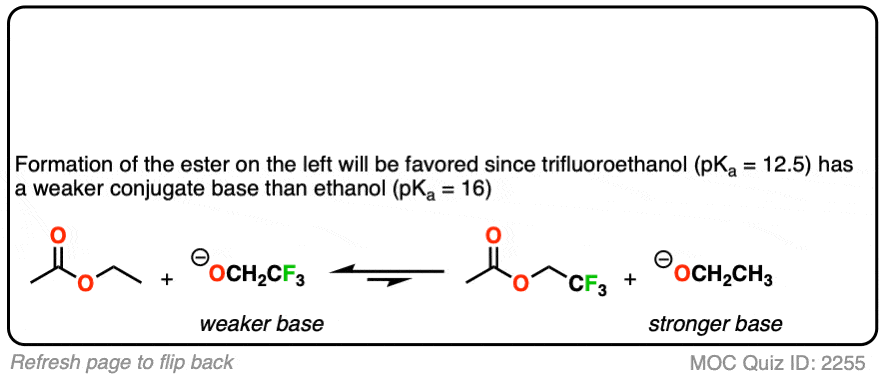
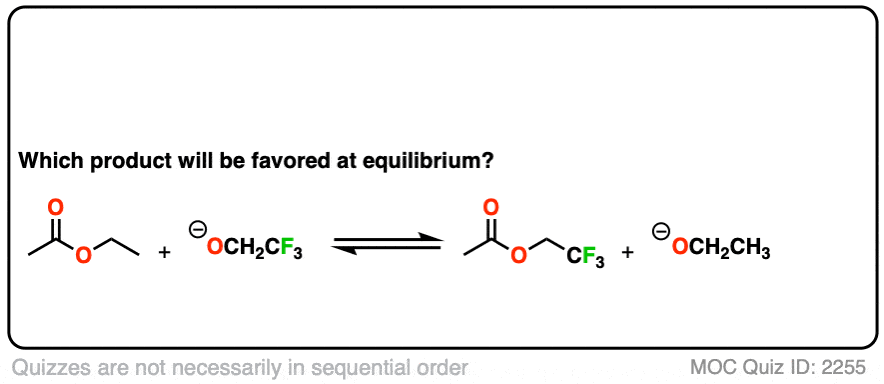
你可能会问——如果没有大的pK呢一个之间的区别亲核试剂而且离去基团?如果我们从乙基开始呢酯比如,想把它转化成甲基酯?
从pK开始一个的方法是类似的,其中一种方法是“淹没该区域”亲核试剂(即使用大量过剩)来推动平衡向所需的产品。
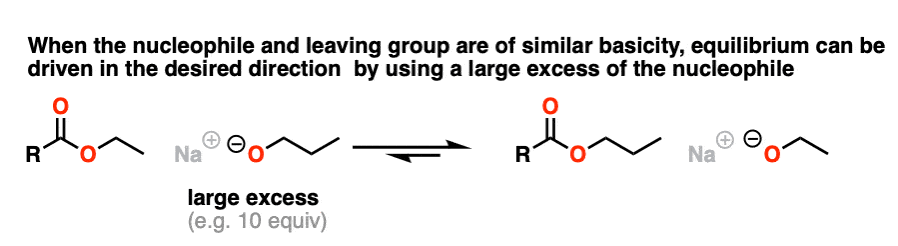
我不是说这是最好的方法(转化为酸卤化物或酸酐,然后处理与酒精会更好)但它仍然是可行的。
7.羧酸……酸!
现在我们已经掌握了影响亲核酰基取代的关键因素,让我们看一个看起来简单的例子,但不是。
NaOH是共轭碱(pK)一个14)和NaOCH3.是共轭碱CH的3.哦(pK一个16)。
所以根据我们所知道的,反应应该对产物有利。对吧?
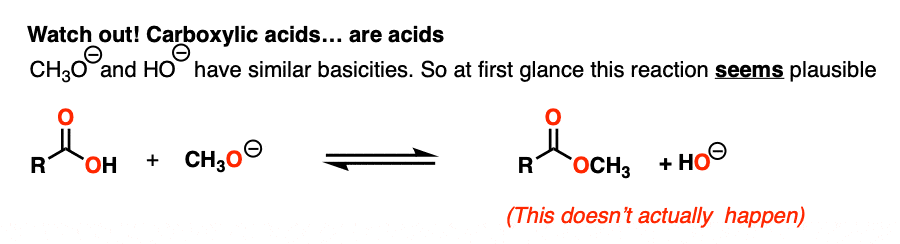
实际上…不!
这是因为我们首先需要考虑一个额外的因素。羧酸也是酸,酸碱反应为快。(见:酸碱反应很快)
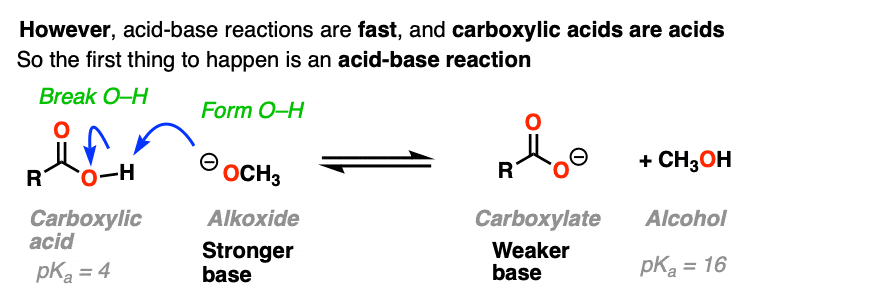
如果亲核酰基取代在这个点发生,它就会加上这个羧酸盐这就意味着di-anion两个负电荷在同一个分子上(如果这听起来不稳定-它是!!).
它是O (2 -) !
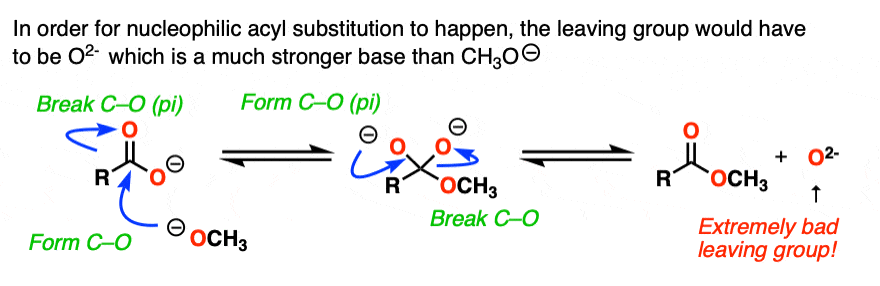
但有一个明显的例外[注6,那是不会发生的。
注意羧酸可以被转换成酯类,但该反应需要酸(例如费歇尔酯化).在这篇文章中,我们关注的是带负电荷的亲核试剂。
8.酯与碱的皂化
如果将RO(-)添加到a羧酸只是导致了去质子化,那么反过来呢?把氢氧根离子加到酯?
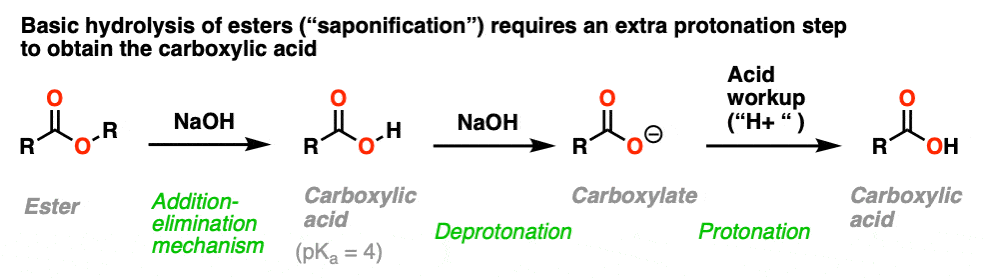
这是一个众所周知的过程皂化(或者仅仅是“碱性水解”)并且效果非常好。
反应的取代部分通过熟悉的过程进行除了- - - - - -消除的过程。这将导致羧酸.然而,由于羧酸是酸,而反应发生在碱性条件下,生成的酸会被氢氧根迅速脱质子生成羧酸盐.
因此要获得中性羧酸在反应结束时,必须在反应步骤中加入酸。
“皂化”这个名字来自于这种反应在制作中的经典用法肥皂(长链脂肪酸的羧酸)脂肪(酯类甘油与长链酸)碱液(碱金属氢氧化物的通称)。
9.分子内NAS
思考你学到的任何新反应的分子内变体总是有帮助的。亲核酰基取代也不例外!
如果是五或六元环可以通常是通过亲核酰基取代形成的。在这个例子中,用强碱氢化钠(NaH)处理会导致an醇盐形成一个新的环,取代甲氧基[CH3.O (-)]
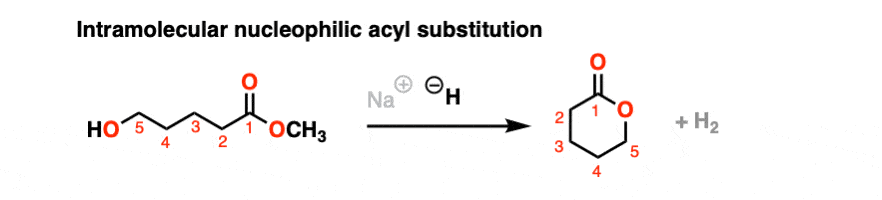
将鼠标悬停在此链接上以查看机制或者点击这个链接.
这里有一个有趣的例子。这里发生了什么?
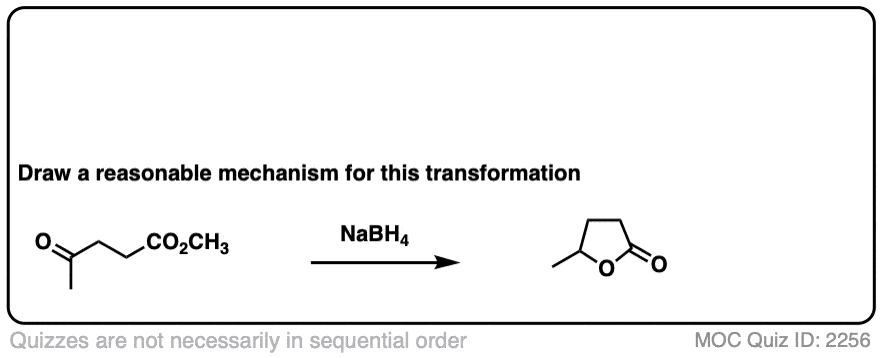 点击翻转
点击翻转
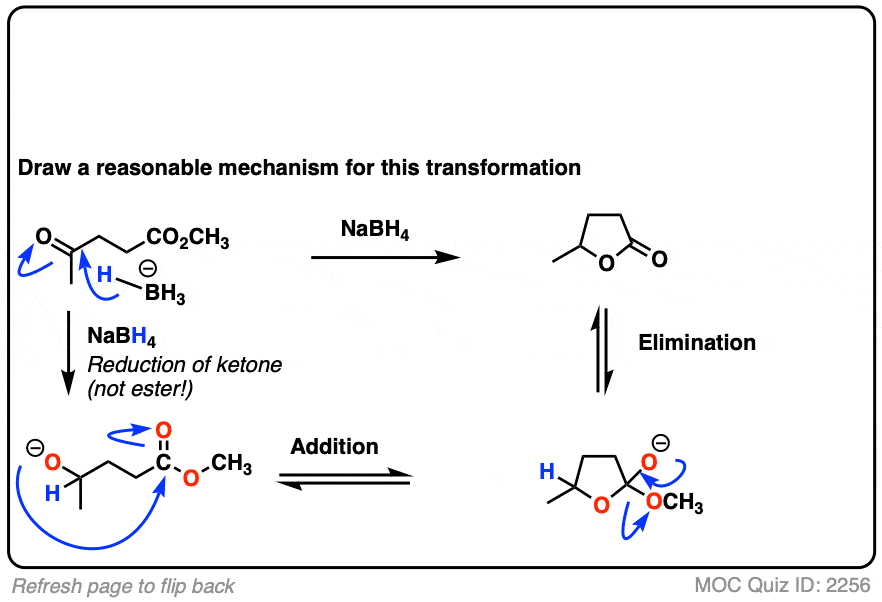
(提示:去质子化并不是产生醇盐)
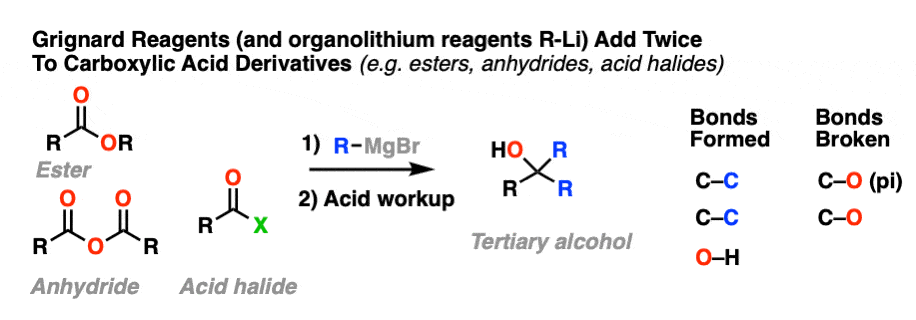
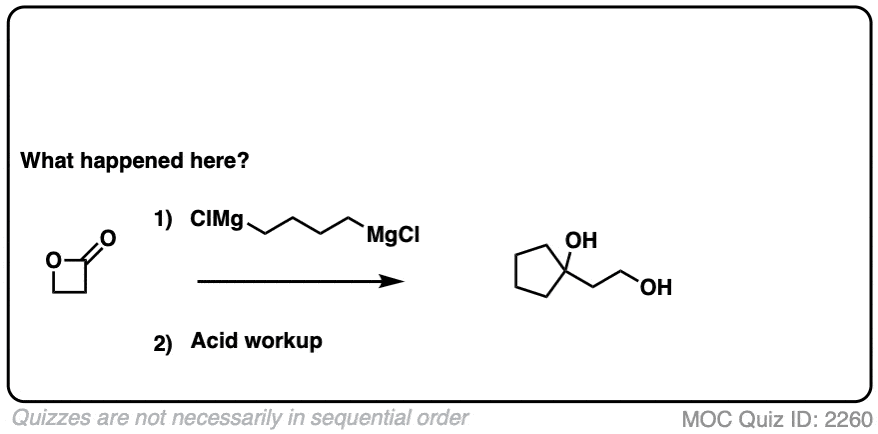
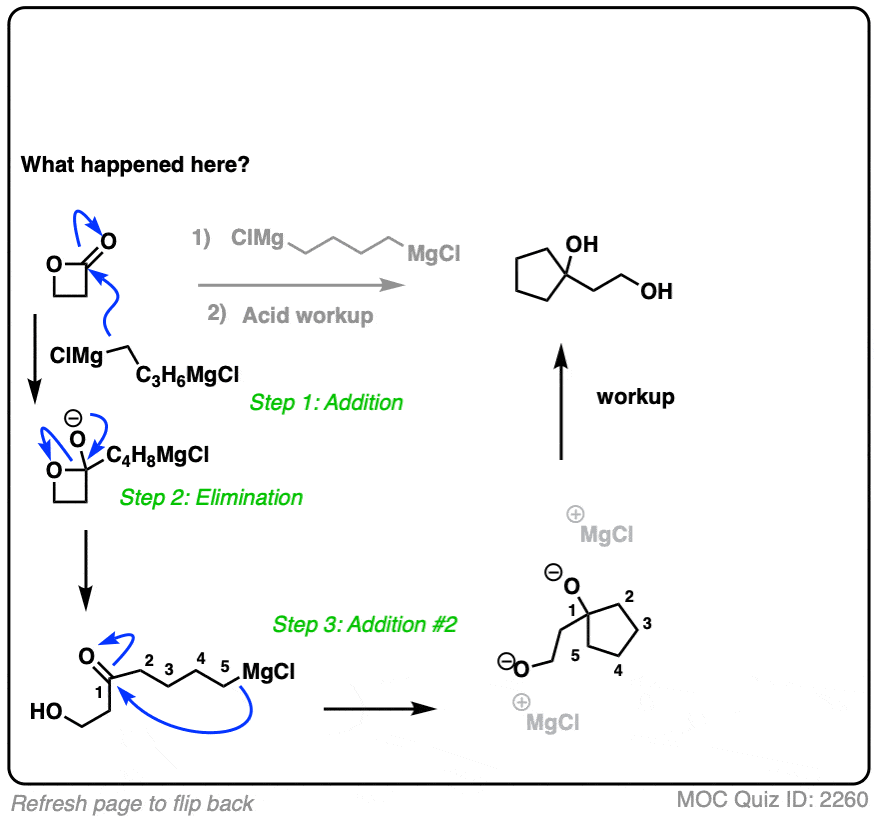
10.当亲核试剂加两次-格氏和LiAlH4
格氏试剂(和有机锂试剂)给予叔醇从酯类、酸卤化物和酸酐。
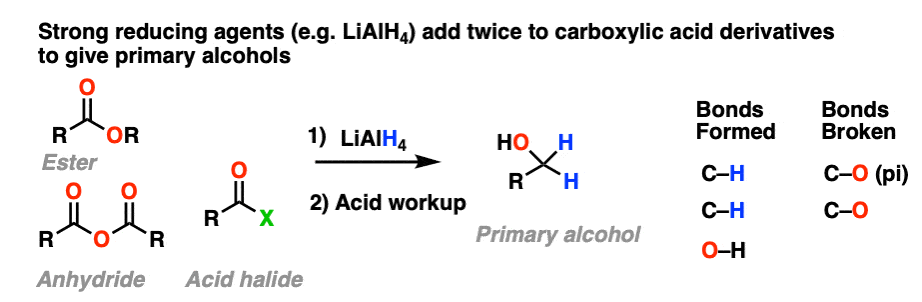
强大的减少代理(例如LiAlH4)给主要醇从酯类、酸卤化物和酸酐。
那么这些“双加法”反应是如何进行的呢?
除了的亲核试剂R(-)或H(-)后面跟着消除的离去基团最初给出一个酮(与Grignards)或醛(LiAlH4).
如果消去过程是快相对于加法,那么醛或酮会在强者面前形成吗亲核试剂之前所有的开始酯(或其他羧酸衍生品)被消费。
因为酮类(和醛类)亲电性比酯类(即。它们和亲核试剂反应更快),这种情况的结果有时被我亲切地称为“饼干怪物反应”:反应形成了一种产品更多的反应向亲核试剂比起始材料。
(因为饼干怪物吃一块饼干就停不下来)。
这个结果在第二秒除了反应发生,变成酒精加酸后。(即使使用一种与格氏等价物,产物仍然是三级产物酒精和未反应的酯.)
所以最终的序列是除了- - - - - -消除- - - - - -除了最后一次身体检查(质子化作用).
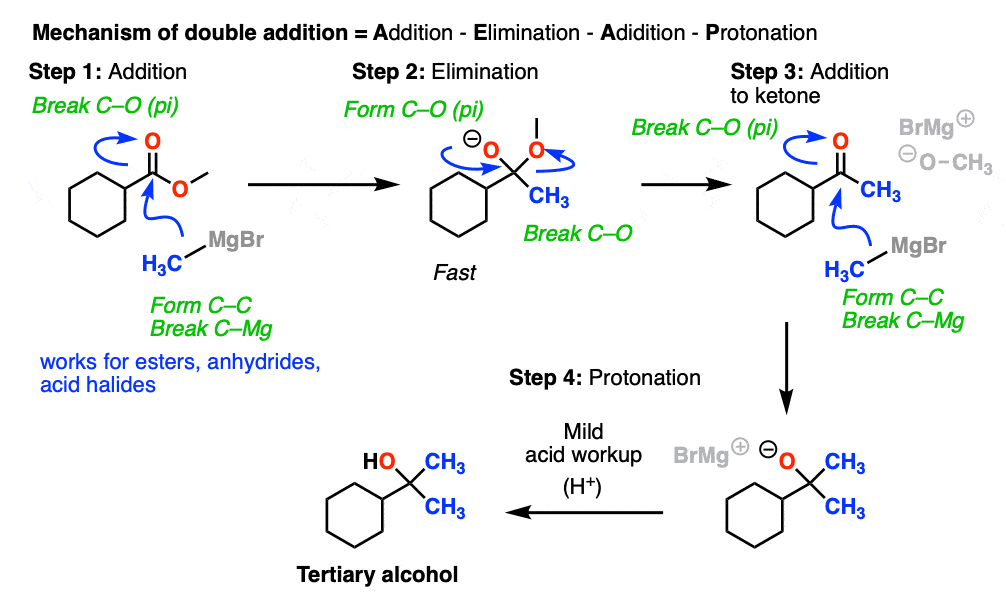
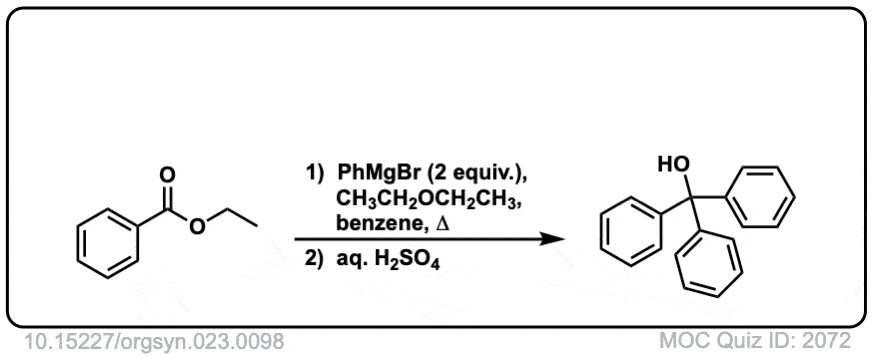
下面是一个具体的例子:
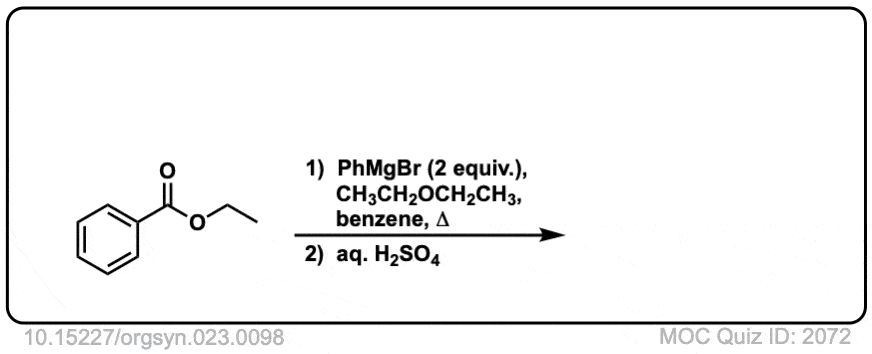 点击翻转
点击翻转
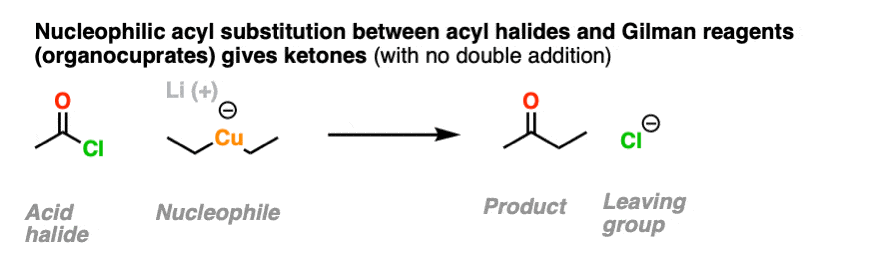
这是有可能得到除酸卤化物停止在酮阶段通过使用有机钴酸盐(吉尔曼试剂),它不像格氏试剂或有机锂试剂那样贪婪。
11.中性亲核试剂与酸催化
这整篇文章都局限于……的反应消极的带电亲核试剂,如格氏化合物、氢化物、酰胺基、醇氧化合物、羧酸酯和卤化物。
我们知道在这些条件下,平衡的方向几乎完全取决于离去基团.这使得酰胺的取代反应很难进行,例如R2N(-)是如此强碱。
还有别的办法吗?
是的。我们应该期待它的加入酸将有助于进行亲核酰基取代,因为共轭酸总是一个更好的离去基.
事实确实如此。看到中性亲核试剂的加成-消除反应(包括酸催化)
这里的折衷是酸性条件与极碱性的亲核试剂如格氏试剂和氢化物试剂不相容。
我们将在下一篇文章中探讨中性和酸性条件下的亲核酰基取代。
12.总结
与带负电荷的亲核试剂的亲核酰基取代反应通过加成-消除机制进行。
- 在第一步(除了)亲核试剂攻击羰基碳,导致a四面体中间。
- 在第二步(消除)碳氧PI键重新形成,a离去基团是流离失所。
- 因为我们在同一个碳上形成和断开一个键这个被归为a取代反应.
- 正向反应和反向反应可以看作是平衡.就像酸碱反应一样,平衡将倾向于产生薄弱的基础.
- 羧酸在碱性条件下通常不会发生亲核取代,因为它们很容易脱质子离去基团(O2-)是高度碱性的。
- 然而,酯类与氢氧根离子进行碱性水解(“皂化”)生成羧酸(质子化后)。
- 分子内的亲核酰基取代反应可以发生,特别是当五元环和六元环可以形成时。
笔记
[注:这篇文章更新了2011年的一篇文章,题为“简化的反应羧酸反应,第一部分
注1 -技术上来说,第一步DIBAL-H还原是配位的羰基氧到路易斯酸铝,随后输送氢化物。但是为了我们的目的,我们可以把它看成H(-)加到羰基碳。
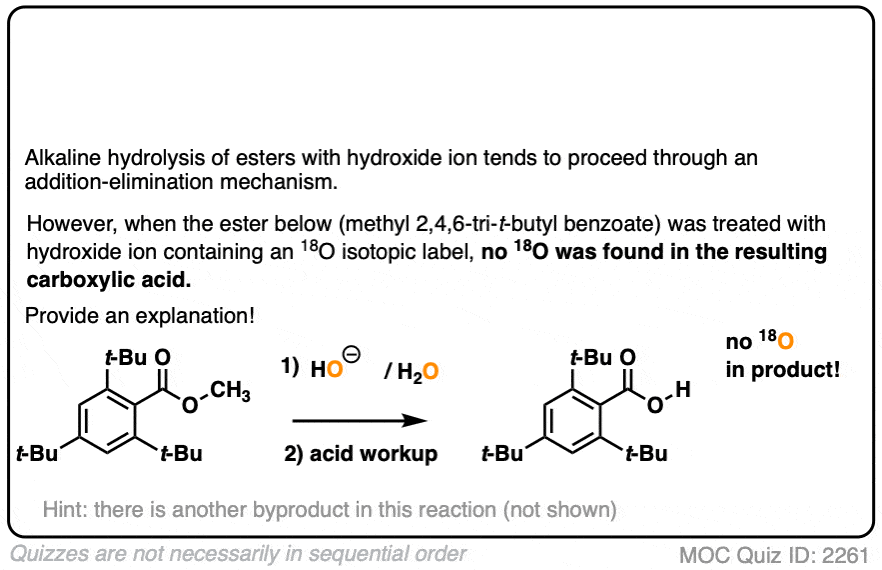
在第一个实验中[裁判),一个酯用含有同位素标记氧的氢氧根处理(18O和“正常”16O)。没有一个恢复的酒精包含了同位素标签。
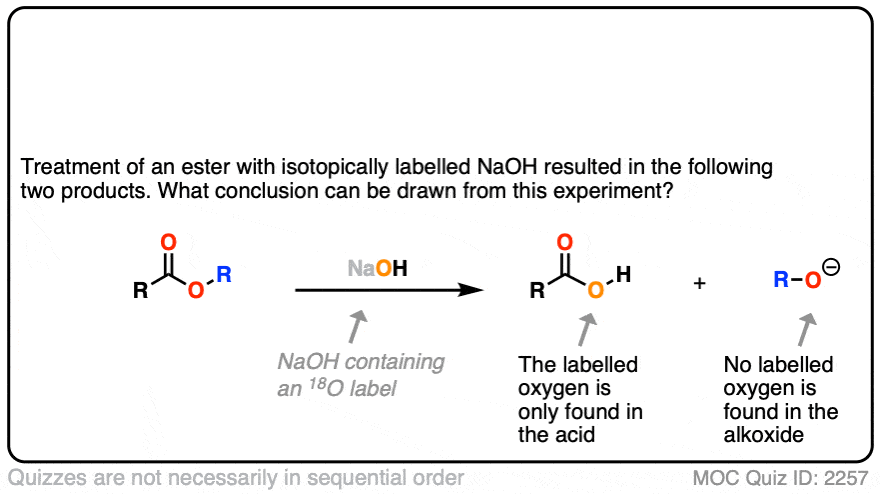 点击翻转
点击翻转
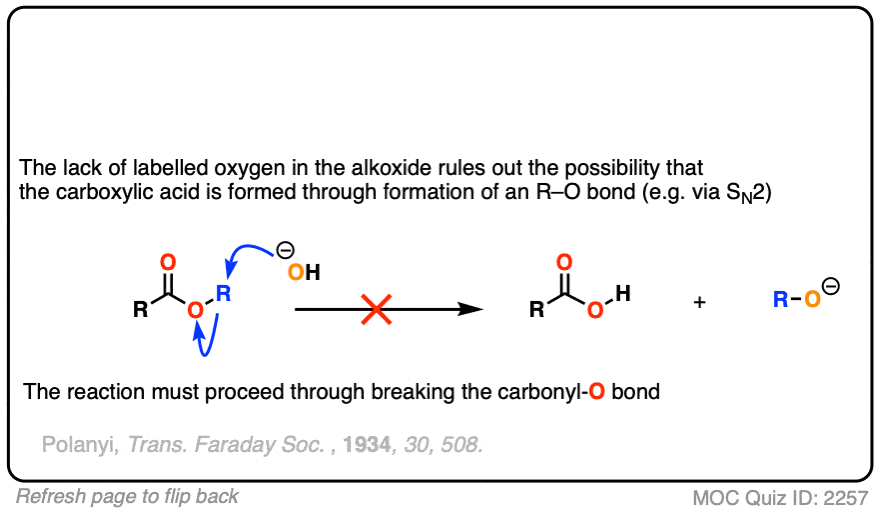
这里得出的结论是羰基-氧键断裂了,而不是烷基-氧键(例如以某种SN2)过程。类似的实验已经在酯类与手性醇和水解醇相结合,可保持其光学纯度.
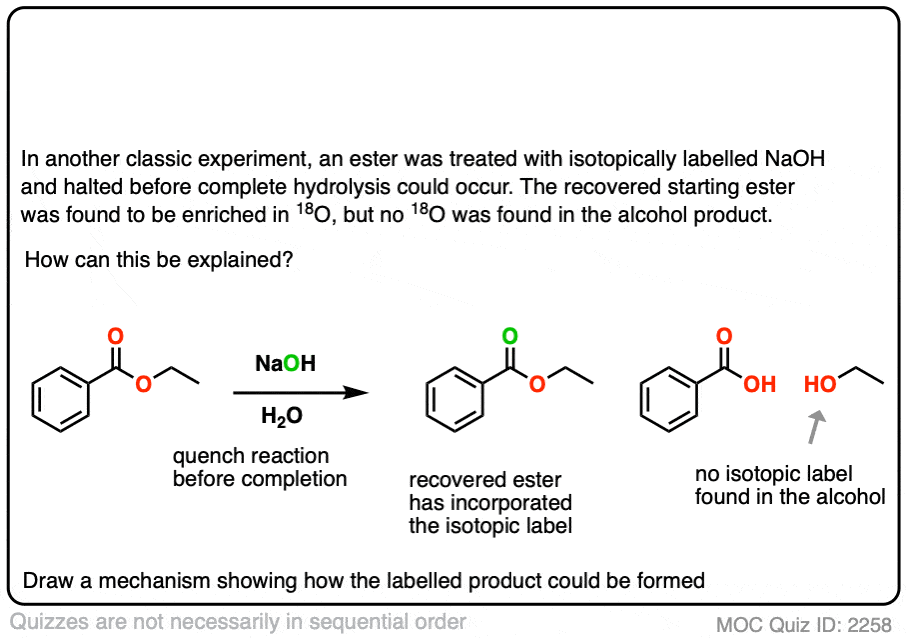
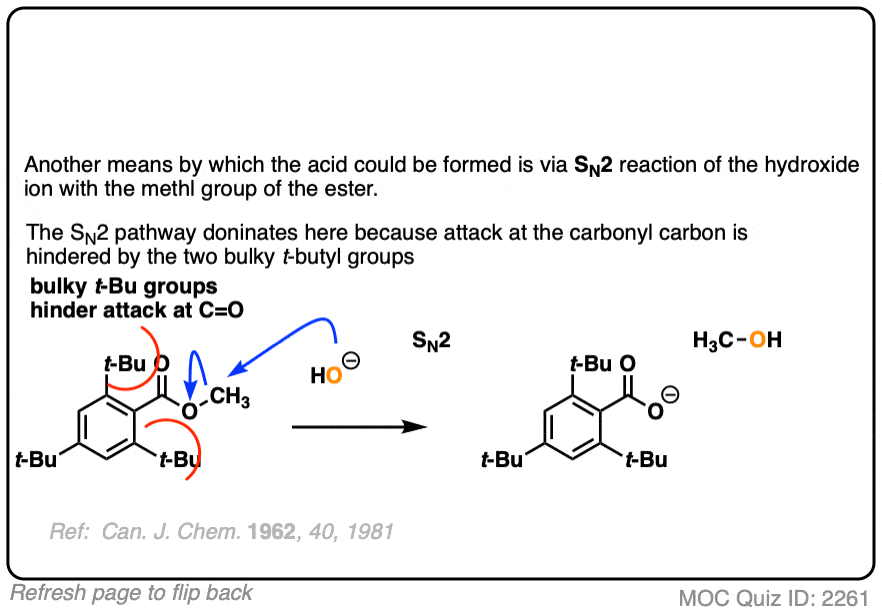
在另一个经典实验中[裁判)一个酯用18O标记氢氧根,反应在完成前停止。
恢复启动酯显示了一些合并18哦,在羰基氧气。从中可以得出什么结论?
 点击翻转
点击翻转
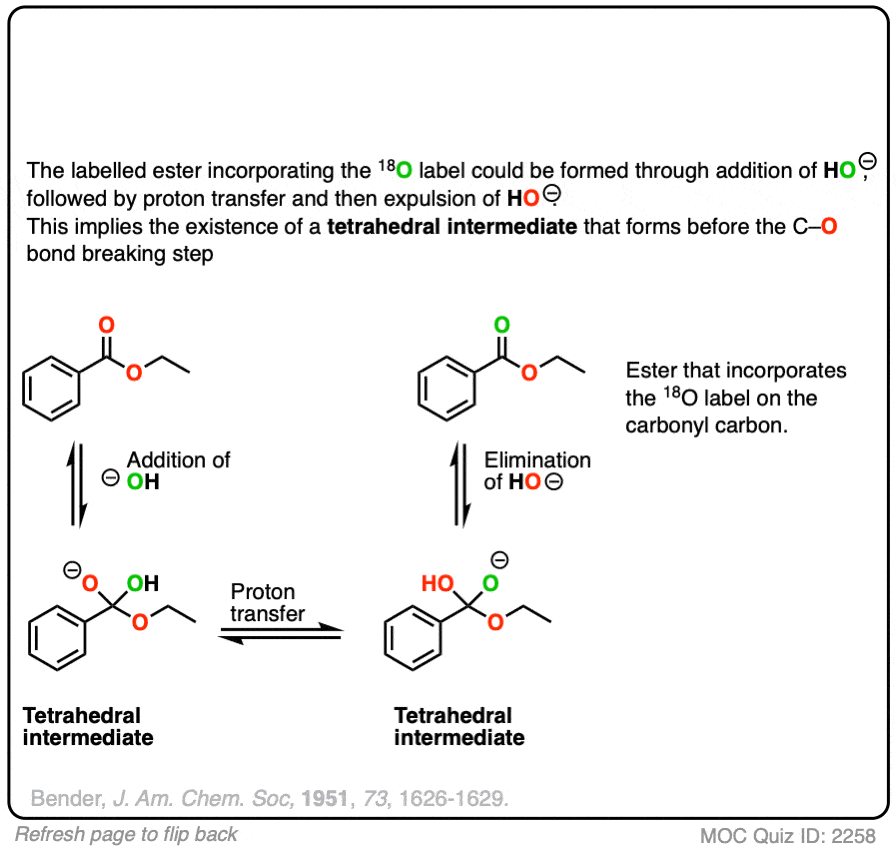
可逆加成18O标记HO(-)可得到一个四面体中间体。假设18O和16O标记的氧具有基本相同的反应性(他们有,在几个百分点之内),质子转移,然后消除16OH会导致启动酯富含18O.不应该发生与-OR组的交换。
这是确定四面体中间体存在的一个关键实验。
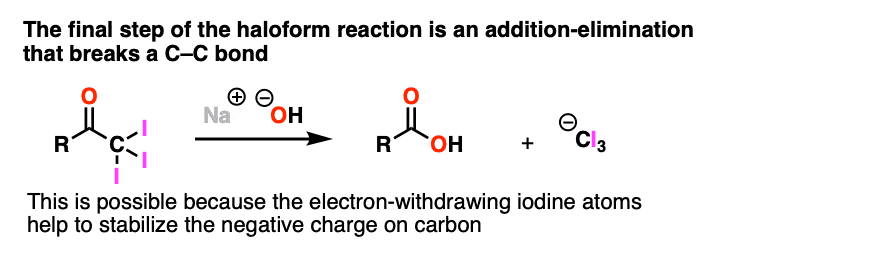
注3。一个值得注意的例外是Haloform反应的最后一步(见:卤仿反应),其中NaOH为加减法亲核试剂导致(-)CI的驱逐3.作为一个离去基团.这是因为吸电子的卤素有助于稳定生成的碳离子。
注意4.只要有足够的热量,酰胺的基本水解就有可能进行,自NH以来,酰胺的水解具有“上坡”的外观2(-)碱比HO(-)碱强。然而,一旦羧酸是形成的,去质子化导致羧酸盐,这使得反应基本上不可逆,因为取代了NH2(-)将不得不给O(2 -)
注5.自然界广泛使用亲核酰基取代反应,硫酯是生物化学中重要的酰基转移试剂。的硫基辅酶A作为离去基团与各种亲核酰基取代反应。
特别重要的是美戊酸途径这导致了萜烯和类固醇的生物合成。
注6。虽然格氏试剂只会将羧酸脱质子生成羧酸盐,但有机锂试剂会将羧酸盐添加到羧酸盐中,生成稳定的四面体中间体,并分解为a酮酸性体检后。
测试你自己!
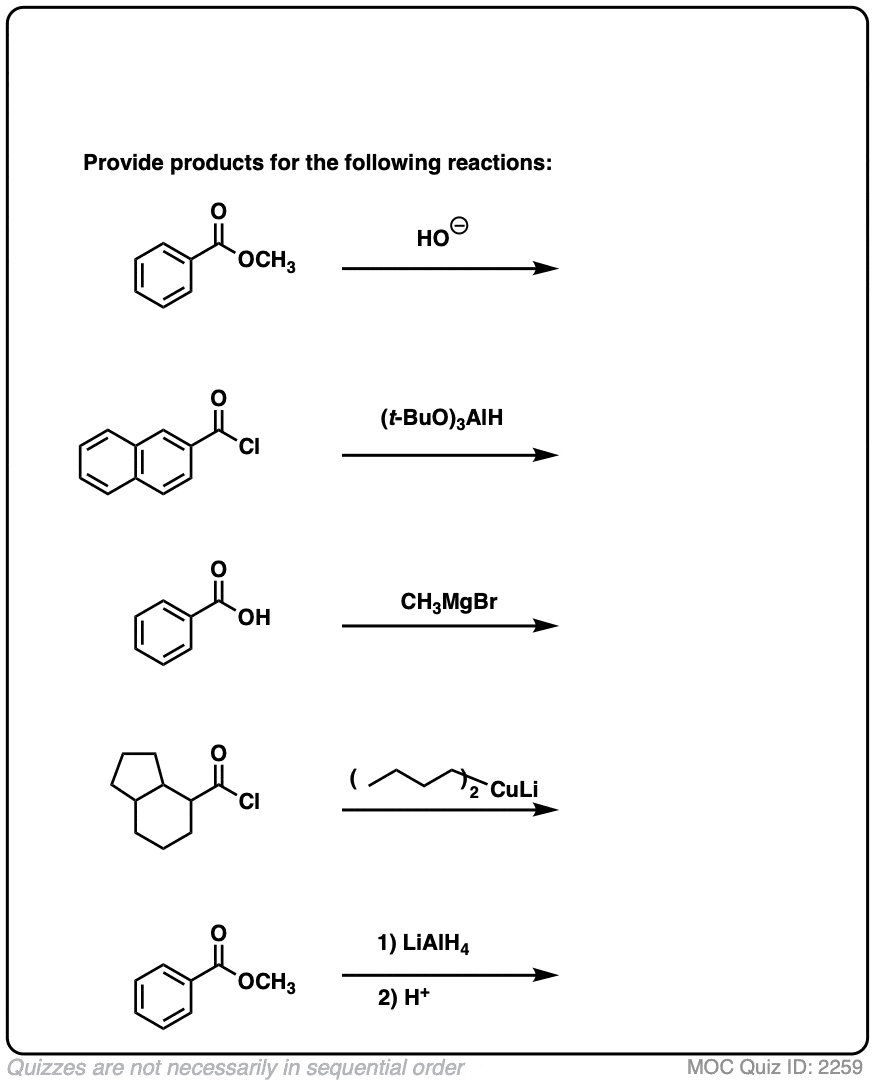 点击翻转
点击翻转
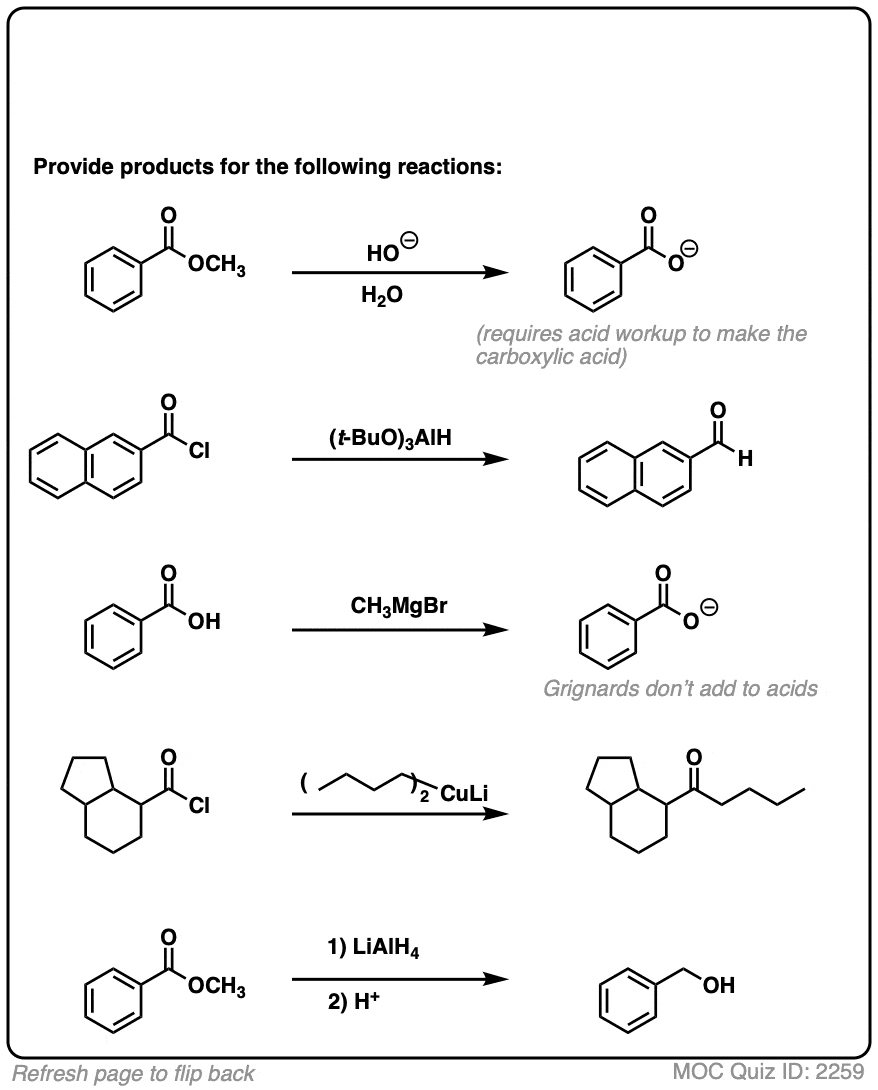
 点击翻转
点击翻转
 点击翻转
点击翻转
 点击翻转
点击翻转
(高级)参考资料和进一步阅读
3月的《高级有机化学》,Carey & Sundberg Part A(第3章)和B(第7章)是关于这一主题的很好的高级来源。雷竞技下载最新版英戈尔德的《有机化学的结构与机理》具有重要的历史意义。
1.对水解机理进行了探讨。乙酸戊酯的碱性皂化
M.波兰尼和A. L.绍博。
反式.法拉第Soc。1934, 30, 508-512
DOI10.1039 / TF9343000508
早期对酰基取代机理的研究使用同位素标记氧来确定酰基- o键裂缝为主要机理酯水解。
2.氧交换作为一种中间物质存在的证据酯水解
迈伦·l·本德
美国化学学会杂志195173(4), 1626 - 1629
DOI:10.1021 / ja01148a063
建立亲核酰基取代中四面体中间体存在的经典实验。Bender对苯甲酸乙酯进行了部分酸性水解18O使水富集并回收18富氧苯甲酸乙酯。
3.空间应变的化学效应十三:硼氢化钠与羰基基团是研究醛和酮的反应性的方便工具
布朗,惠勒,市川
四面体, 1(3),1957, 214 - 220。
DOI:10.1016 / 0040 - 4020 (57) 88041 - 7
的速率常数的有益研究NaBH4变成各种醛和酮。
4.植物亲核反应的催化机理羧酸衍生品。
迈伦·l·本德
化学评论196060(1), 53 - 113
DOI:10.1021 / cr60203a005
亲核酰基取代反应机理研究进展。
亲爱的先生,
在我为印度理工学院JEE做化学准备时,真的帮了我很多忙。
~ Abhay
真的是很棒的表现。对于高级竞争性考试非常有用。
你的网站是如此珍贵。它帮助我爱上了有机化学,并在考试中取得了好成绩。非常感谢。
嗨,玛丽,谢谢你,我很高兴你发现这个网站很有用。祝福你,詹姆斯
上帝保佑你!!对这么难的课程来说,这是了不起的工作!!
”4。亲核酰基取代不起作用"
酯和酸酐的标记混淆了。
我非常喜欢你们的网站,谢谢!:)
谢谢你的提醒!固定的。
精心设计!对于热心的学习者来说,这是一颗宝石:)
谢谢你!
对于酯与OH-的亲核酰基取代,为什么OR-是离去基?
在显示离去基pKa的图中,OH-似乎是比OR-稍好的离去基。如果是,为什么反应还会发生?图表表明这是一个特例,但我不确定为什么。
好问题。亲核酰基取代的产物是羧酸。
现在你有一个羧酸(pKa = 4)和醇酸(醇的共轭碱,pKa约为16)。
然后脱质子生成羧酸盐。
现在发生了什么?
如果把RO(-)加到羧酸盐上,为了亲核酰基取代的发生,离去基就必须是O(2-)基本上,这是不可能的。
为什么由于苯基或乙烯基的附着,相应羧酸的酸度反而增加,而不是由于共振效应而预期的降低?
好问题。这可能是由于附着在羰基上的芳香环sp2杂化碳原子的感应效应。你可以认为它们具有更大的有效电负性,因为它们有33%的s特性(而sp3为25%),电子被紧紧地束缚在原子核上。