家/与羰基的常见错误:羧酸…是酸的!
有机化学学习
与羰基的常见错误:羧酸…是酸的!
最后更新:2022年10月31日|
羧酸…是酸的。
我知道这似乎是显而易见的。但附近确定学生组织首次2偶尔会忘记这一点。
这里有两个常见的错误,我看到* *。
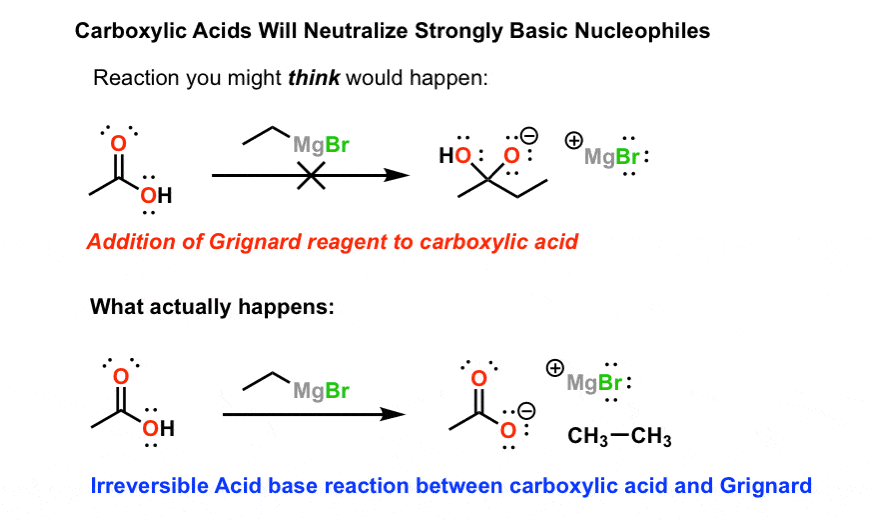
1)与羧酸格氏试剂的反应。
格利雅试剂(总体结构RMgBr)是伟大的亲核试剂。他们添加酮,醛,酯类(两次)、酸卤化物(两次)、环氧化合物和其他一些羰基包含的化合物。
他们没有。
这是因为羧酸…酸,格氏试剂非常强大的基地。因此,而不是增加羰基首先碳,格氏只是质子化了的。以及由此产生的共轭碱的羧酸(一个羧酸盐)太不起化学反应的进一步反应。
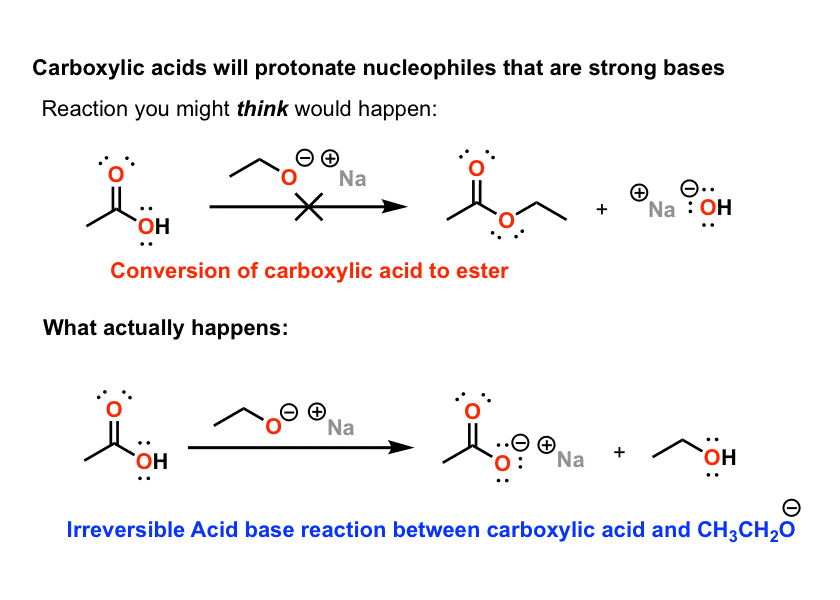
2)反应和醇盐(deprotonated醇)
羧酸等衍生品酯类,酐,酸卤化物具有良好的亲核试剂反应良好HO -和RO -。模式变得熟悉的很快:1、2之外,紧随其后的是1、2取消。看到这种模式,学生得到误一种虚假的安全感,羧酸反应这种方式。
他们不因为同样的原因,格氏试剂没有。羧酸是酸。他们使质子化强碱(如醇盐),留下羧酸盐-再次,这是稳定。
看起来愚蠢的重复这三分之一的时间,但它发生了* *。你可能不认为你会这样做。很有可能,在某些时候,你会的。这是很容易犯的错误。假设它最后一次:
羧酸…。酸!
- - - - -
注意以下:这是一个很好的经验法则假设会发生酸碱反应速度比反应涉及亲核攻击,比如之外金属羰基合物。如果你喜欢的话,有一个名字:至少运动的原则。这就是为什么我们之前看到格氏试剂的质子化作用时间增加羰基碳。
01焊接、结构和共鸣
- 我们怎么知道甲烷(CH4)是四面体吗?
- 杂化轨道和杂交
- 如何确定杂交:捷径
- 轨道杂化和债券的优势
- σ键有六种:π键
- 一个关键技能:如何计算形式电荷
- 部分费用给线索电子流
- 四个分子间作用力以及它们是如何影响沸点
- 3影响沸点的趋势
- 如何使用电负性来确定电子密度(以及为什么不相信形式电荷)
- 介绍了共振
- 如何使用弯曲的箭头来交换共振形式
- 评价磁共振形式(1)——费用最小的原则
- 如何找到最好的共振结构通过应用电负性
- 评估与负电荷共振结构
- 评估与正电荷共振结构
- 探索共振:Pi-Donation
- 探索共振:Pi-acceptors
- 总之:评估共振结构
- 画共振结构:3避免常见的错误
- 如何理解应用电负性和共振反应
- 债券杂交实践
- 结构和成键练习测验
- 共振结构的实践
02酸碱反应
03烷烃和命名法
04构象和环烷
05年有机反应的底漆
- 最重要的问题,当学习一门新反应
- 4反应的主要类Org 1
- 学习新的反应:电子移动如何?
- (为什么)电子流如何
- 第三个最重要的问题,当学习一门新反应
- 7因素稳定负电荷有机化学
- 7因素稳定有机化学中正电荷
- 常见错误:正式指控可以误导
- 亲核试剂与亲电试剂
- 弯曲的箭头(反应)
- 弯曲的箭头(2):最初的反面和最终的正面
- 亲核性与碱性
- 的三个类亲核试剂
- 是什么让一个好亲核试剂?
- 是什么让一个好的离去基团?
- 3因素,稳定的碳正离子
- 三个因素破坏碳正离子
- 过渡态是什么?
- 哈蒙德的假设
- 格罗斯曼的统治
- 首先画丑陋的版本
- 学习有机化学反应:一个清单(PDF)
- 介绍加成反应
- 介绍了消除反应
- 介绍自由基取代反应
- 介绍了氧化裂解反应
06自由基反应
07年立体化学和手性
08年置换反应
09年消除反应
11SN1 SN2 / E1、E2的决定
12烯烃的反应
- 烯烃E和Z符号(+顺/反式)
- 烯烃的稳定性
- 加成反应:消除的相反
- 选择性与特定的
- 在烯烃加成反应的区域选择性
- 烯烃加成反应的立体选择性:Syn vs反加法
- 马氏的HCl烯烃
- 烯烃Hydrohalogenation机制以及它如何解释马氏规则的像
- 箭头和烯烃加成反应
- 除了模式# 1:“碳正离子通路”
- 重组在烯烃加成反应
- 溴化烯烃的
- 烯烃的溴化:机制
- 烯烃加成模式# 2:“三元环”的途径
- 硼氢化反应,烯烃的氧化
- 硼氢化反应烯烃氧化机制
- 烯烃加成模式# 3:“协同”的途径
- Bromonium离子形成:一个(小)Arrow-Pushing困境
- 第四个烯烃加成模式——自由基
- 烯烃的反应:臭氧分解
- 简介:三个关键的家庭烯烃反应机制
- 钯碳催化加氢(Pd / C)
- OsO4(四氧化锇)Dihydroxylation烯烃
- m-CPBA (meta-chloroperoxybenzoic酸)
- (4)-烯烃合成反应地图,包括烷基卤化物的反应
- 烯烃反应实践问题
13炔的反应
14醇、环氧化合物和醚
- 醇-命名法和属性
- 醇可以作为酸或碱(以及为什么它重要)
- 醇的酸度和碱度
- 威廉姆森醚合成
- 威廉姆森醚合成:规划
- 从烯烃醚,叔卤代烃和Alkoxymercuration
- 醇通过酸催化醚
- 劈理的醚酸
- 环氧化合物醚家族的离群值
- 的环氧化合物与酸
- 环氧开环与基础
- 卤代烃与醇
- 甲苯磺酸盐和甲磺酸
- PBr3和SOCl2
- 消除反应的醇
- 消除醇与POCl3烯烃
- 酒精氧化:“强大”和“弱”氧化剂
- 阐明酒精氧化反应的机制
- 分子内反应的醇类和醚类
- 保护组醇
- 硫醇和硫醚
- 计算一个碳的氧化态
- 在有机化学氧化和还原
- 氧化梯子
- SOCl2机制醇烷基卤化物:SN2和SNi
- 酒精反应路线图(PDF)
- 酒精反应练习题
- 环氧化物反应测试
- 氧化和还原练习测验
15有机金属化合物
16光谱学
17二烯烃和MO理论
- 有机化学2中会发生什么
- 这些分子共轭吗?
- 结合有机化学共振
- π成键和反键轨道
- 分子轨道的烯丙基阳离子,烯丙基自由基和烯丙基阴离子
- 丁二烯的π分子轨道
- 二烯烃的反应:1、2和1、4
- 热力学和动力学产品
- 添加更多的1、2和1、4二烯烃
- s-cis和s-trans
- Diels-Alder反应
- 循环二烯烃和Diels-Alder亲二烯体反应
- Diels-Alder反应的立体化学
- 一昼夜的桤木挂式vs Endo产品:如何分辨它们
- 在一昼夜的HOMO和LUMO桤木的反应
- 为什么Endo vs挂式产品青睐Diels-Alder反应?
- Diels-Alder反应:动力学和热力学控制
- 复古Diels-Alder反应
- 分子内一昼夜的桤木的反应
- Regiochemistry Diels-Alder反应
- 应对和克莱森重组
- Electrocyclic反应
- Electrocyclic开环和闭包(2)——六个或八个π电子
- 一昼夜的桤木练习题
- 分子轨道理论实践
18芳香性
19芳香分子的反应
- 亲电芳香取代:介绍
- 激活和去活化组织在亲电芳香取代反应
- 亲电芳香取代的机制
- 昊图公司,Para -和元董事亲电芳香取代反应
- 理解邻、对位、和元董事
- 为什么卤素昊图公司-帕拉-董事?
- 双取代的苯:最强的捐赠者“赢”
- 亲电芳香取代(1)——卤化苯
- 亲电芳香取代(2)——硝化、磺化
- 东亚峰会(3)——傅克酰化和傅克烷基化反应
- 分子内的傅克反应
- 亲核性芳香取代(NAS)
- 亲核芳香替代(2)-苯炔机制
- 反应在“苄基的“碳:溴化和氧化
- Wolff-Kishner Clemmensen,羰基和其他减少
- 更多的反应芳香Sidechain:减少硝基和拜耳威利格
- 芳香族合成(1)——“操作”
- 合成的苯衍生物(2)-极性倒转
- 芳香族合成(3)-磺酰阻断组
- 桦树减少
- 苯的合成(7):反应地图和相关的芳香族化合物
- 芳香族合成反应和实践
- 亲电芳香取代实践问题
谢谢! !
我也困惑这个问题。
现在我明白了!:)
所以有办法添加烷基羧酸团体?让说我想去从羧酸叔代替酒精。
如果你使用organolithium试剂可以添加烷基羧酸形成酮组。这些也将deprotonate羧酸,羧酸盐,但足以增加随后形成碳碳键。不过我相信中间形成相当稳定,不会消除给酮,直到检查。叔醇的你必须提交酮到另一个相当于organolithium(或格氏如果你喜欢)。希望这回答了你的问题。
坦克,我很困惑
大多数grinard与碳水化合物反应。酸吗?
如下所示,他们通常是质子化了的!
谢谢你帮助我这么多
羧酸+胺是另一种常见的质子转移的例子,学生小姐。我不知道有多少RC (= NR)哦我看过,这是很多产品。
谢谢的帮助所以你怎么能准备一个从羧酸酯没有实施费歇尔酯化反应吗?
啊. .尴尬的感觉当你意识到你忘记你所知道的哦,所以就在几天前。
嗨,詹姆斯!
好的文章,我理解它,当我看到最后一个学期,但最近我遇到Organolithium反应你在评论中提到。我有点困惑为什么如果你添加2等价物Organolithium您可以使用第一个deprotonate和第二加上但是你不能做同样的事情用2的格氏试剂。这仅仅是格氏是弱吗?我一直以为这两个是极为强大的亲核试剂/基地和没有太多的不同。
困惑但很开明(弗兰克·w·)
这是马特,我是一个家教,通过掌握有机。弗兰克回答你的问题,我将首先同意乍一看似乎有点疯狂,格氏会deprotonate羧酸而烷基锂不可逆转地形成一个二阶阴离子通过顺序去质子化/加法。在大多数上下文格氏和烷基锂的反应一样,虽然烷基锂更常去质子化的具体目标时,我注意到(例如方面形成)。如果你学习足够的机制最终会临到这些令人沮丧的不一致的例子必须由一些合理化的手挥舞着。这是可能的,没有人知道确切的答案可能有:
1)略强路易斯酸性李+阳离子在这种情况下
2)略高的亲核性C-Li债券相比C-Mg债券
不过,这可能是一个简化和我欢迎的实验数据或计算研究的人都知道,解释这一点。机制本身可能是完全不同的,因为这些试剂有时做时髦的东西,如单电子转移(套)激进的机制。
马特,我想说你的答案(1)很好,但你的回答(2)是多余的。根据定义,如果R-Li更加被动,因为这意味着它有更高的亲核性。”
但李回路易斯酸度。你可以比较不同LiAlH4 NaAlH4或NaBH4 LiBH4。在这两种情况下,李盐反应更大。很多的差异可能是由于路易斯酸度,但也可以溶解影响反应性的差异。事实上,溶解/路易斯酸度几乎占啦,NaBH4之间的反应性的差异。热化学的研究光离子AlH4 BH4,表明没有区别的氢化物结合能,并激活能量减少的二氧化碳没有溶剂和抗衡离子AlH4和BH4的相同。
这并不总是容易想到诸如有机金属化合物的结构或无机盐在有机溶液。即使是细微的差别在乙醚、四氢呋喃等结构可以改变溶解特性,这些东西可以在反应性有很大影响。幸运的是,我们有人像汉斯帝国和戴夫·科来帮助我们更好地理解它。
谢谢你!我的怀疑是解决:)
伟大的解释!
将格氏试剂与旁边的酸性α氢反应C = O RCOCl吗?
一般不会,除非酸性氯化物格外受阻。碳氢键不deprotonate尽快地1)必须有重组以来债券(rehybridization)的债券,和2)碳氢键的酸度是依赖与羰基的对齐。
其他官能团可能会导致类似的问题吗?
羟基(OH),硫醇(SH),通常和其他温和的酸性官能团。羧酸是目前最常见的情况之一的邂逅。
请解释:格氏试剂+羧酸氯- >酮+ Mg-halides。
是C-Cl债券活性,排除简单的质子化作用说格里纳?
“羧酸氯”的意思,“酸氯”,事实上不含酸性氢。质子化作用的格利雅不是一个问题,尽管它会与羧酸。
你能解释为什么哈佛商业评论不添加羰基的亲核加成? ?
C-Br债券远弱于切断π键。即使C-Br债券形式,它将很快被驱逐了重新生成羰基。
谢谢
的亲核试剂与HCOO是不可能的——为什么?即使它不与格氏试剂反应
羧酸盐实际上有两个氧原子之间的电荷离域,这也许可以解释为什么它不是热衷于表现得像一个羧基化合物。
是的,没错。带负电荷的氧是一种强π捐赠者和羰基碳不亲电出于这个原因。
我太困惑而解决问题。这篇文章wayy清晰。
谢谢。
我现在的困惑是完全消灭
…
使酒精格氏试剂